高中化学人教版(2019)必修第一册 第三章第二节 金属材料
试卷更新日期:2020-10-20 类型:同步测试
一、单选题
-
1. 镁合金可用于制笔记本电脑外壳、自行车框架等,下列叙述正确的是( )A、镁合金的硬度比镁小 B、镁必须密封保存 C、镁合金是电的绝缘体 D、氧化膜使镁条常温下不与氧气反应2. 下列转化过程不能一步实现的是( )A、Al(OH)3→Al2O3 B、Al2O3→Al(OH)3 C、Al→AlCl3 D、Al→NaAlO23. 称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )A、1:1 B、1:2 C、1.87:1 D、3.65:14. 表面有氧化膜的铝片,投入到足量的NaOH溶液中,充分反应( )A、n(还原剂):n(氧化剂)=1:3 B、Al(OH)3表现了弱碱性 C、氧化剂是NaOH D、n(生成AlO2-):n(生成H2)=2:35. 下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )A、Na和O2 B、Na2CO3和HCl C、AlCl3和NaOH D、NaOH和NaHCO36. 将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )A、3 mol·L-1盐酸 B、4 mol·L-1 HNO3溶液 C、8 mol·L-1NaOH溶液 D、18 mol·L-1 H2SO4溶液7. 两份铝屑,第一份与过量的盐酸反应,第二份与过量的氢氧化钠溶液反应,产生氢气的体积比为1∶2,则第一份与第二份铝屑的质量比为( )A、1∶1 B、1∶2 C、1∶3 D、1∶48. 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
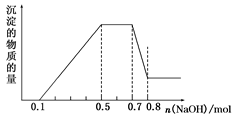 A、溶液中一定不含CO32- , 可能含有SO42-和NO3- B、在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O C、溶液中的阳离子只有H+、Mg2+、Al3+ D、n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1
A、溶液中一定不含CO32- , 可能含有SO42-和NO3- B、在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O C、溶液中的阳离子只有H+、Mg2+、Al3+ D、n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1二、填空题
-
9. 用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.
①Al与NaOH溶液反应的离子方程式为 .
②焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
③经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为 .
10. 如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)﹣(4)对应的是
溶液
加入物质
对应的图象
⑴饱和石灰水
通过量CO2气体
⑵氯化铝溶液
加入过量氨水
⑶MgCl2、AlCl3的混合液
逐滴加入NaOH溶液至过量
⑷含少量NaOH的NaAlO2溶液
逐滴加入稀盐酸
11. 围绕下列七种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3 , 根据要求回答下列问题.(1)既能与强酸反应,又能与强碱反应的是 (填序号).
(2)属于电解质的是 (填序号).
(3)写出最适宜制取Al(OH)3的离子方程式: .
(4)两物质间发生反应的离子方程式为H++OH﹣=H2O,请写出该反应的化学方程式: .
(5)34.2g⑦溶于水配成500mL溶液,则溶液中SO42﹣的物质的量浓度为 .
三、推断题
-
12. A,B,C,D 均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
 (1)、若 D 是金属,C 溶液在储存时应加入少量 D,其理由是(用必要的文字和离子方程式 表示)。(2)、若 A、B、C 为含同一种金属元素的无机化合物,请写出 B 转化为 C 的所有可能的离 子力程式:。13. 已知A、B为常见的非金属单质且常温下均为气体,甲、乙为金属单质,乙在I的浓溶液中发生钝化,C为极易溶于水的气体而且水溶液呈碱性,而H为一种强碱,各物质间的转化关系如下图(部分生成物未给出,且未注明反应条件):
(1)、若 D 是金属,C 溶液在储存时应加入少量 D,其理由是(用必要的文字和离子方程式 表示)。(2)、若 A、B、C 为含同一种金属元素的无机化合物,请写出 B 转化为 C 的所有可能的离 子力程式:。13. 已知A、B为常见的非金属单质且常温下均为气体,甲、乙为金属单质,乙在I的浓溶液中发生钝化,C为极易溶于水的气体而且水溶液呈碱性,而H为一种强碱,各物质间的转化关系如下图(部分生成物未给出,且未注明反应条件):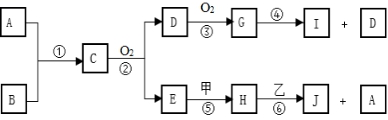 (1)、已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每消耗3mol G,生成I的物质的量为mol。(2)、实验室制取C物质的化学方程式为:。(3)、已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:。当反应中转移3mol电子时,生成A在标准状况下的体积为L
(1)、已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每消耗3mol G,生成I的物质的量为mol。(2)、实验室制取C物质的化学方程式为:。(3)、已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:。当反应中转移3mol电子时,生成A在标准状况下的体积为L四、综合题
-
14. 将共0.4molMg、Al的混合物用盐酸完全溶解,放出标准状况下11.2L气体,然后再滴2mol/LNaOH溶液,请回答:(1)、求该混合物中Mg、Al的物质的量之比(2)、若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V= mL。(3)、若该Mg、Al混合物溶于400mL 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3 , 则滴入NaOH溶液的体积最少为 mL。15. 将wg镁和铝的混合物投入25mL4mol·L-1盐酸中,固体全部溶解后,得到标准状况下896mL气体(不考虑金属和盐酸反应时HCl的挥发)。向所得溶液中加入20mLNaOH溶液时,生成沉淀的质量达到最大。(1)、NaOH溶液的物质的量浓度为mol·L-1。(2)、沉淀的质量达到最大时为g(用含w的表达式表示)。16. 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/ LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示。
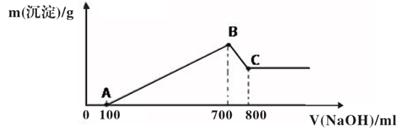
请填写下列空白:
(1)、图中B点沉淀的成分(填化学式)(2)、写出AB段发生反应的离子方程式 , ;(3)、写出BC段发生反应的离子方程式;(4)、合金中铝的质量为;(5)、盐酸的物质的量浓度(假设反应后溶液体积不变)是 。17. 铝和铝合金是一类重要的金属材料。回答下列问题:(1)、除去镁粉中混有少量铝粉,应加入的试剂为 , 然后经过滤、洗涤、干燥。(2)、等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 H2在同温同压下的体积之比是。(3)、现有 AlCl3和 MgSO4混合溶液,向其中不断加入 NaOH 溶液,得到沉淀的物质的量与加入 NaOH 溶液的体积之间的关系如图所示。原溶液中 Cl- 与SO42- 的物质的量之比为。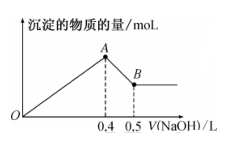 (4)、某同学在实验室用铝土矿(含有 Al2O3和SiO2 , 不考虑其他杂质)制取金属铝的流程如下:
(4)、某同学在实验室用铝土矿(含有 Al2O3和SiO2 , 不考虑其他杂质)制取金属铝的流程如下: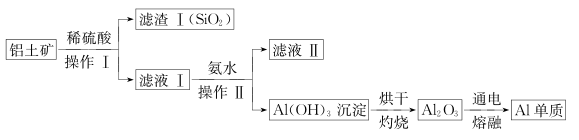 ①Al2O3与稀硫酸反应的离子方程式为 。
①Al2O3与稀硫酸反应的离子方程式为 。②滤液II中溶质的用途之一是 。
③电解熔融的 Al2O3除得到金属铝之外,还可得到的气体产物是 (填化学式)。工业上在电解熔融的 Al2O3 时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低 Al2O3的熔点。冰晶石在物质的分类中属于(填字母)。
a.酸 b.碱 c.盐 d.氧化物