高中化学人教版(2019)必修第一册 第三章第一节 铁及其化合物
试卷更新日期:2020-10-20 类型:同步测试
一、单选题
-
1. 可用于检验久置的FeSO4溶液是否变质的试剂( )A、过氧化钠 B、铁粉 C、盐酸 D、KSCN溶液2. 高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂.工业上可先制得高铁酸钠(离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+ 3Cl-+5H2O).然后在高铁酸钠溶液中加入一定量的KOH.可析出高铁酸钾.下列说法不正确的是( )A、高铁酸钾能除去水中溶解的H2S等 B、高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀毒 C、工业上制各高铁酸钠时每生成1mol还原产物,转移3mol电子 D、高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降3. 下列物质反应后一定有+3价铁生成的是( )
①Fe与过量的S反应 ②Fe与过量稀硫酸反应后,再向其中加KNO3
③Fe(NO3)2溶液中加少量盐酸 ④Fe和Fe2O3的混合物溶于盐酸中
A、①② B、②③ C、①②③ D、①②③④4. 要证明某溶液中不含Fe3+而可能含有Fe2+ , 进行如下实验操作时最佳顺序为( )①加入适量氯水②加入足量的KMnO4溶液③加入少量KSCN溶液.
A、①③ B、③② C、③① D、①②③5. 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )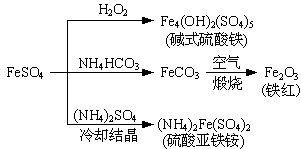 A、碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 B、为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 D、常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大6. 下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )
A、碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 B、为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 D、常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大6. 下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )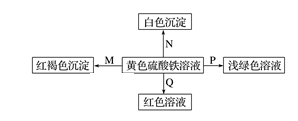
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
铜
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
锌粉
KSCN
D
Na2O2
MgCl2
Fe
KSCN
A、A B、B C、C D、D7. 向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )A、11.2g B、5.6g C、2.8g D、无法计算8. 在一定条件下,铁与有关物质的反应,所得产物错误的为( )A、Fe FeCl3 B、Fe FeS C、Fe Fe(OH)3 D、Fe Fe3O49. 铁粉与水蒸气在一定条件下可以反应,下列说法错误的是( ) A、用火柴点燃前需要检验气体的纯度 B、火焰的颜色为淡蓝色 C、反应后试管中生成红棕色固体 D、168g铁粉与足量水蒸气完全反应时,转移8mol电子10. 莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列说法正确的是( )A、配制0.1mol·L-1莫尔盐溶液500mL,需莫尔盐19.6克 B、可与含Fe2+、HClO、H+、Cl﹣微粒的溶液大量共存 C、加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)3↓ D、取样,加入铁氰化钾,若出现黄色沉淀,证明含Fe2+
A、用火柴点燃前需要检验气体的纯度 B、火焰的颜色为淡蓝色 C、反应后试管中生成红棕色固体 D、168g铁粉与足量水蒸气完全反应时,转移8mol电子10. 莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列说法正确的是( )A、配制0.1mol·L-1莫尔盐溶液500mL,需莫尔盐19.6克 B、可与含Fe2+、HClO、H+、Cl﹣微粒的溶液大量共存 C、加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)3↓ D、取样,加入铁氰化钾,若出现黄色沉淀,证明含Fe2+二、实验探究题
-
11. 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
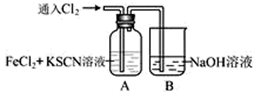 (1)、A中铁元素发生反应的离子方程式有。(2)、为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在(填化学符号)。(3)、资料显示:SCN--的电子式为
(1)、A中铁元素发生反应的离子方程式有。(2)、为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在(填化学符号)。(3)、资料显示:SCN--的电子式为 。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是(填名称)。 12.(1)、I.现有五种溶液,分别含下列离子:①Ag+ , ②Mg2+ , ③Fe2+ , ④Al3+ , ⑤Fe3+。
。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是(填名称)。 12.(1)、I.现有五种溶液,分别含下列离子:①Ag+ , ②Mg2+ , ③Fe2+ , ④Al3+ , ⑤Fe3+。写出符合下列条件的离子符号:既能被氧化又能被还原的离子是 , 加铁粉后溶液增重的是;
(2)、向Fe2+的溶液中滴加NaOH溶液,现象是。(3)、除去FeCl2中FeCl3中所涉及的离子方程式:。(4)、II.如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是: , 该实验证明起漂白作用的是。(填化学式)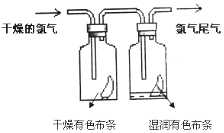 (5)、①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示);
(5)、①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示);②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是(填化学式)。
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示) , 。
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是(填字母代号)。
A.O2 B.Cl2 C.CO2 D.HClO
三、综合题
-
13. 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。(1)、向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是nm。(2)、电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式。某同学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少量待测溶液,滴入KSCN溶液呈红色,则溶液中所含金属阳离子有。(3)、若要验证该溶液中含有Fe2+ , 正确的实验方法是________(用字母代号填)。
A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。 B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。 C、向试管中加入试液,先滴入KSCN溶液,无现象,再滴加氯水,若显血红色,证明原溶液中含有Fe2+(4)、欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下:
①写出上述实验中有关物质的化学式:A:;B:。
②写出通入 C的化学方程式
14. 某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题: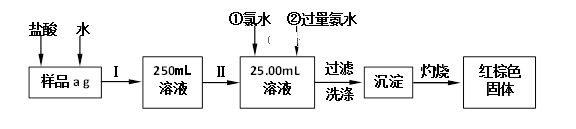 (1)、操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、。(2)、写出加入氯水发生的离子反应方程式。(3)、写出加入过量氨水发生的离子反应方程式。(4)、写出灼烧发生反应的化学方程式。(5)、检验沉淀是否已经洗涤干净的操作是。(6)、下列操作可能使所配溶液浓度偏小的是(填写序号)。
(1)、操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、。(2)、写出加入氯水发生的离子反应方程式。(3)、写出加入过量氨水发生的离子反应方程式。(4)、写出灼烧发生反应的化学方程式。(5)、检验沉淀是否已经洗涤干净的操作是。(6)、下列操作可能使所配溶液浓度偏小的是(填写序号)。①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)、若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是。15. 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。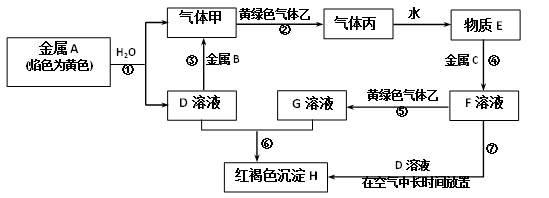
请根据以上信息完成下列各题:
(1)、写出下列物质的化学式:B、丙。(2)、写出黄绿色气体乙的一种用途 , 反应过程⑦可能观察到的实验现象是。(3)、写出反应①的化学方程式,并用单线桥法标出电子转移的方向和数目:。(4)、反应③中的氧化剂是(写化学式,下同),反应④中的还原剂是。(5)、写出反应⑤的离子方程式。