广东省深圳市光明区2019-2020学年九年级上学期化学期末考试试卷
试卷更新日期:2020-10-19 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法中正确的是( )A、滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污 B、CO、CO2、SO2均为空气污染物 C、把秸秆、杂草、人畜粪便等废弃物放在密闭的沼气池中发酵,产生的沼气可以做燃料 D、用水喷淋燃着的酒精以降低着火点2. 光明区的变化欣欣向荣,下列主要涉及化学变化呈观出来的是( )A、大仟里广场上的霓虹灯闪烁 B、光明农场的牛奶发酵成酸奶 C、新城公园雨后空气里出现的彩虹 D、孩子用2B铅笔在图画本上描绘光明的高楼大厦3. 规范的实验操作是安全地进行实验并获得成功的保证。下列实验操作正确的是( )A、连接仪器
 B、溶解NaCl固体
B、溶解NaCl固体  C、熄灭酒精灯
C、熄灭酒精灯  D、滴加液体
D、滴加液体  4. 下列有关实验现象的说法正确的是( )A、紫色石蕊遇到醋酸变红色 B、硫在空气中燃烧,产生明亮的蓝紫色火焰,有刺激性气味的气体生成 C、红磷在空气中燃烧,产生白雾 D、铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色熔融物生成5. 下列化学用语表达正确的是( )A、3S:“3” 表示三个硫元素 B、CaCl2中 Ca元素的化合价为-2价 C、Mg+2“表示一个镁离子带两个单位正电荷 D、CO2:“2” 表示一个二氧化碳分子中含有两个氧原子6. 银杏果中含有银杏酸(化学式:C22H34O3; 相对分子质量:346)。下列有关银杏酸说法正确的是( )A、银杏酸中氢元素质量分数最小 B、银杏酸分子中含有一个O3分子 C、银杏酸中碳、氢元素的质量比为11:17 D、银杏酸为氧化物7. 如图是五种粒子的结构示意图,下列说法错误的是( )
4. 下列有关实验现象的说法正确的是( )A、紫色石蕊遇到醋酸变红色 B、硫在空气中燃烧,产生明亮的蓝紫色火焰,有刺激性气味的气体生成 C、红磷在空气中燃烧,产生白雾 D、铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色熔融物生成5. 下列化学用语表达正确的是( )A、3S:“3” 表示三个硫元素 B、CaCl2中 Ca元素的化合价为-2价 C、Mg+2“表示一个镁离子带两个单位正电荷 D、CO2:“2” 表示一个二氧化碳分子中含有两个氧原子6. 银杏果中含有银杏酸(化学式:C22H34O3; 相对分子质量:346)。下列有关银杏酸说法正确的是( )A、银杏酸中氢元素质量分数最小 B、银杏酸分子中含有一个O3分子 C、银杏酸中碳、氢元素的质量比为11:17 D、银杏酸为氧化物7. 如图是五种粒子的结构示意图,下列说法错误的是( ) A、①③属于同种元素 B、③⑤化学性质相似 C、②③④均表示离子 D、①④形成的化合物是AlCl38. 如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法错误的是( )
A、①③属于同种元素 B、③⑤化学性质相似 C、②③④均表示离子 D、①④形成的化合物是AlCl38. 如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法错误的是( ) A、甲元素属于非金属元素 B、乙原子的相对原子质量为22.99g C、乙原子的核内质子数为11 D、甲、乙两种元素形成化合物的化学式是NaBr9. 对下列物质分类正确的是( )A、石墨、红磷、干冰是单质 B、食盐水、澄清石灰水、稀盐酸属于溶液 C、高锰酸钾、二氧化锰、氧化铜是氧化物 D、空气、冰水混合物、硫酸铜,是混合物10. 下列有关物质的变化描述正确的是( )A、食物腐败是缓慢氧化引起的 B、酒精燃烧既是化合反应也是氧化反应. C、工业制取二氧化碳和实验室制取二氧化碳的方法都属于分解反应 D、生石灰、硝酸铵溶于水都放热,发生了化学变化11. 已知反应前后分子变化的微观示意图如下所示。下列说法正确的是( )
A、甲元素属于非金属元素 B、乙原子的相对原子质量为22.99g C、乙原子的核内质子数为11 D、甲、乙两种元素形成化合物的化学式是NaBr9. 对下列物质分类正确的是( )A、石墨、红磷、干冰是单质 B、食盐水、澄清石灰水、稀盐酸属于溶液 C、高锰酸钾、二氧化锰、氧化铜是氧化物 D、空气、冰水混合物、硫酸铜,是混合物10. 下列有关物质的变化描述正确的是( )A、食物腐败是缓慢氧化引起的 B、酒精燃烧既是化合反应也是氧化反应. C、工业制取二氧化碳和实验室制取二氧化碳的方法都属于分解反应 D、生石灰、硝酸铵溶于水都放热,发生了化学变化11. 已知反应前后分子变化的微观示意图如下所示。下列说法正确的是( ) A、物质A为甲烷,其分子由碳原子和氢分子构成 B、物质B中氧元素的化合价为-2价 C、该反应前后原子种类和数目均发生改变 D、该反应生成物C和D的质量比为11:912. 如图是“空气中氧气含量的测定”实验,说法错误的是( )
A、物质A为甲烷,其分子由碳原子和氢分子构成 B、物质B中氧元素的化合价为-2价 C、该反应前后原子种类和数目均发生改变 D、该反应生成物C和D的质量比为11:912. 如图是“空气中氧气含量的测定”实验,说法错误的是( ) A、装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性 B、实验中红磷要过量,以消耗容器内全部氧气 C、冷却后水倒流瓶内,可测定空气中氧气的含量 D、可用木炭、铁丝代替红磷,测定空气中氧气的含量13. 下列关于空气的说法正确的是( )A、空气中的氮气约占总质量的78% B、空气中的氧气能燃烧 C、空气中的稀有气体可制作多种电光源 D、空气中的二氧化碳会造成酸雨,是大气污染物14. 下图实验不能说明的是( )
A、装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性 B、实验中红磷要过量,以消耗容器内全部氧气 C、冷却后水倒流瓶内,可测定空气中氧气的含量 D、可用木炭、铁丝代替红磷,测定空气中氧气的含量13. 下列关于空气的说法正确的是( )A、空气中的氮气约占总质量的78% B、空气中的氧气能燃烧 C、空气中的稀有气体可制作多种电光源 D、空气中的二氧化碳会造成酸雨,是大气污染物14. 下图实验不能说明的是( )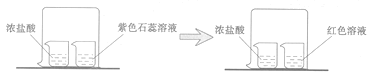 A、分子很小 B、分子不停地运动 C、构成物质的微粒不同,性质不同 D、化学反应的实质是分子破裂为原子,原子重新结合成新分子15. 下列变化中,能用质量守恒定律解释的是( )A、10g冰溶化成10g的水 B、5g硝酸钾溶解在50g水中,成为55g硝酸钾溶液 C、纸燃烧后质量减少 D、50mL水加入50mL酒精中,溶液的体积小于100mL16. 在3A+B=2C+D的反应中,已知30gA和10gB恰好完全反应,生成5gD,且已知A的相对分子质量为40,则C的相对分子质量是( )A、70 B、60 C、50 D、8017. 小红对蜡烛燃烧过程进行了一系列实验探究,下列说法错误的是( )
A、分子很小 B、分子不停地运动 C、构成物质的微粒不同,性质不同 D、化学反应的实质是分子破裂为原子,原子重新结合成新分子15. 下列变化中,能用质量守恒定律解释的是( )A、10g冰溶化成10g的水 B、5g硝酸钾溶解在50g水中,成为55g硝酸钾溶液 C、纸燃烧后质量减少 D、50mL水加入50mL酒精中,溶液的体积小于100mL16. 在3A+B=2C+D的反应中,已知30gA和10gB恰好完全反应,生成5gD,且已知A的相对分子质量为40,则C的相对分子质量是( )A、70 B、60 C、50 D、8017. 小红对蜡烛燃烧过程进行了一系列实验探究,下列说法错误的是( ) A、实验①中,蜡烛燃烧一会儿后,会熄灭,说明燃烧需要氧气 B、实验②中,蜡烛燃烧一会儿后,看到白瓷板出现上黑色的小颗粒,说明蜡烛中含有碳元素 C、实验③中,细木棍与火焰接触的两端颜色最黑,说明外焰温度最高 D、实验④中,只能说明二氧化碳不支持燃烧这一性质。18. 如图是碳还原氧化铜的实验,有关说法正确的是( )
A、实验①中,蜡烛燃烧一会儿后,会熄灭,说明燃烧需要氧气 B、实验②中,蜡烛燃烧一会儿后,看到白瓷板出现上黑色的小颗粒,说明蜡烛中含有碳元素 C、实验③中,细木棍与火焰接触的两端颜色最黑,说明外焰温度最高 D、实验④中,只能说明二氧化碳不支持燃烧这一性质。18. 如图是碳还原氧化铜的实验,有关说法正确的是( ) A、该实验体现了碳的氧化性 B、反应开始的标志是:导管口有气泡产生 C、该反应的实验现象是黑色固体变红色,澄清石灰水变浑浊 D、实验结束时应先熄灭酒精灯,待试管冷却后再将导管从澄清石灰水中移出19. 我们探究CO2性质时做过以下一组对比实验,该对比实验得出的结论是( )
A、该实验体现了碳的氧化性 B、反应开始的标志是:导管口有气泡产生 C、该反应的实验现象是黑色固体变红色,澄清石灰水变浑浊 D、实验结束时应先熄灭酒精灯,待试管冷却后再将导管从澄清石灰水中移出19. 我们探究CO2性质时做过以下一组对比实验,该对比实验得出的结论是( )
①CO2密度比空气密度大 ②CO2 能够与水发生化学反应 ③CO2 能使干石蕊纸花变色 ④稀醋酸能使干石蕊纸花变色
A、①② B、①④ C、②④ D、②③20. 下列有关化学知识归纳与整理完全正确的一组是( )A物质与用途
B化学与安全
①用干冰制造舞台上的云雾效果
②石灰石可用于食品干燥剂
③石墨可用于做电极
①点燃H2前一定要验纯
②汽车到加油站加油,严禁烟火
③在室内放-盆水, 可防止煤气中毒
C化学与环境
D元素与物质
①工业废水处理达标后排放
②减少化石燃料的使用,开发新能源
③PM2.5是造成雾霾天气的元凶之一
①入体含量最多的物质是水
②地壳中含量最多的元素是铝元素
③天然存在最硬的物质是金刚石
A、A B、B C、C D、D21. 下列关于溶液的说法正确的是( )A、均一稳定的液体是溶液 B、常温下,饱和的澄清石灰水是稀溶液 C、溶液中只能有一种溶质 D、一定温度下,向饱和食盐水中加食盐,溶液的质量增加22. 如图表示a、b、c三种物质的溶解度曲线。下列说法正确的是( ) A、t1℃时 a、c饱和溶液升温到t2℃,均变为不饱和溶液 B、t1℃时, 125 克b的饱和溶液中,含有b物质25克 C、a中含有少量b时,可采用蒸发结晶的方法提纯a D、P点表示t1℃时,a、b溶液的溶质质量分数相等23. 关于溶液的配制,下列的说法错误的是( )A、配制溶液的主要实验步骤为:①计算 ②称量 ③量取 ④溶解 B、配制溶液的过程中,玻璃棒的作用是搅拌 C、量取水的体积时,仰视读数,会导致溶质质量分数变大 D、装瓶时,有少量液体洒出,溶质质量分数不变24. 下表列出了除去物质中所含少量杂质的方法,其中错误的是( )
A、t1℃时 a、c饱和溶液升温到t2℃,均变为不饱和溶液 B、t1℃时, 125 克b的饱和溶液中,含有b物质25克 C、a中含有少量b时,可采用蒸发结晶的方法提纯a D、P点表示t1℃时,a、b溶液的溶质质量分数相等23. 关于溶液的配制,下列的说法错误的是( )A、配制溶液的主要实验步骤为:①计算 ②称量 ③量取 ④溶解 B、配制溶液的过程中,玻璃棒的作用是搅拌 C、量取水的体积时,仰视读数,会导致溶质质量分数变大 D、装瓶时,有少量液体洒出,溶质质量分数不变24. 下表列出了除去物质中所含少量杂质的方法,其中错误的是( )选项
物质
所含杂质
除去杂质的方法
A
CaO
CaCO3
将固体在高温下充分灼烧
B
N2
O2
将气体缓缓通过足量的灼热铜网
C
CO2
CO
点燃
D
KCl
MnO2
溶解、过滤、蒸发
A、A B、B C、C D、D25. 下列图像能正确反映其对应关系的是( )A、在一定温度下,向接近饱和的硝酸钾溶液中加入硝酸钾固体 B、用等质量、等浓度的双氧水分别制取氧气
B、用等质量、等浓度的双氧水分别制取氧气  C、电解水两电极产生氢气和氧气的质量比
C、电解水两电极产生氢气和氧气的质量比  D、加热高锰酸钾制氧气时,反应前后试管中固体药品锰元素的质量分数
D、加热高锰酸钾制氧气时,反应前后试管中固体药品锰元素的质量分数 
二、填空题
-
26. 用化学用语填空(1)、2个铵根离子;(2)、保持氩气化学性质的最小粒子是;(3)、生活中常用作食品干燥剂的氧化物是;(4)、标出三氧化二氮中氮元素的化合价;(5)、溶解度随温度升高而减小的固体物质是。
三、简答题
-
27. 2019年3月22-28日是第32届“中国水周”,本届活动的宣传主题为“坚持节水优先,强化水资源管理”。请回答下列与水有关的问题:(1)、河水中含有较多可溶性的钙、镁化合物,如Ca(HCO3)2 , 会给生活和生产带来诸多不便,为了降低硬度,生活中可采用的方法是。 在此过程中,水中的Ca(HCO3)2 会发生分解生成难溶性的碳酸钙、水、二氧化碳,该反应的化学方程式为。可用来鉴别硬水和软水。(2)、自制净水器中常加入;用于去除水中的异味和色素。(3)、李明同学收集到一瓶浑浊的河水,并要将其制成蒸馏水,其过程如图所示:

A物质的名称是;操作①的名称是;需要用到的玻璃仪器有烧杯、;玻璃棒,其中玻璃棒的作用是;李明同学将液体C放入蒸馏装置中制备蒸馏水,同时需要在蒸馏烧瓶中放入沸石,其作用是。
(4)、李明同学利用制得的蒸馏水和如图所示的简易装置,验证水的组成。
实验时,加入少量的硫酸钠或氢氧化钠,目的是 , 装置中的b端应与电源的极相连,用燃着的木条检验甲气体,现象为。该实验说明水由组成,反应方程式为。
四、实验题
-
28. 下图是实验室制备气体的装置和用品,请根据要求回答问题:
 (1)、仪器F的名称是。可用于高锰酸钾制氧气的发生装置是(填序号),装置中发生的化学反应方程式为。(2)、若用双氧水制氧气,最好选用EF组合成发生装置,理由是。(3)、实验室可在装置J中制取CO2 , 反应方程式为。检验J装置气密性的方法是:从长玻璃管口加入一定量的水,然后用止水夹夹紧橡胶管,将长玻璃管向上提起一段后静置, 如观察到 , 则气密性良好。如果用I装置收集CO2 , 则气体应从(填“a”或“b”)管口通入。(4)、用J装置制CO2具有的优点是。若从B~H中选择B与(填序号)进行组合,也可以组成一套具有同样优点的装置。
(1)、仪器F的名称是。可用于高锰酸钾制氧气的发生装置是(填序号),装置中发生的化学反应方程式为。(2)、若用双氧水制氧气,最好选用EF组合成发生装置,理由是。(3)、实验室可在装置J中制取CO2 , 反应方程式为。检验J装置气密性的方法是:从长玻璃管口加入一定量的水,然后用止水夹夹紧橡胶管,将长玻璃管向上提起一段后静置, 如观察到 , 则气密性良好。如果用I装置收集CO2 , 则气体应从(填“a”或“b”)管口通入。(4)、用J装置制CO2具有的优点是。若从B~H中选择B与(填序号)进行组合,也可以组成一套具有同样优点的装置。五、流程题
-
29. 超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意图如下:
 (1)、石灰石中主要成分的化学式为 , 石灰窑中发生的反应方程式为。(2)、在乳化池中,生石灰与水发生反应,该反应属于反应,其化学方程式为。(3)、过筛的目的是拦截(填“大于”或“小于”)筛孔直径的颗粒。(4)、碳化塔中反应的化学方程式为。
(1)、石灰石中主要成分的化学式为 , 石灰窑中发生的反应方程式为。(2)、在乳化池中,生石灰与水发生反应,该反应属于反应,其化学方程式为。(3)、过筛的目的是拦截(填“大于”或“小于”)筛孔直径的颗粒。(4)、碳化塔中反应的化学方程式为。六、计算题
-
30. 2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜,锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
39.92
59.84
79.80
99.80
(1)、黄铜粉末完全反应生成氢气的总质量为g。(2)、该黄铜中铜的质量分数为多少? (写出计算过程)(3)、第三次实验中溶质的种类为。
-
-
-
-