浙教版科学 九年级上册 第二章 物质转化与材料应用 单元测试卷(基础)
试卷更新日期:2020-10-14 类型:单元试卷
一、单选题
-
1. 下列物质属于有机化合物的是( )
①CO2 ②H2CO3 ③Na2CO3
④CH4 ⑤C2H5OH
A、①②③④ B、①③⑤ C、③④⑤ D、④⑤2. 下列说法不正确的是( )A、塑料是最常见的有机合成材料,具有密度小、耐腐蚀、易加工等优点 B、NaOH 溶液可以除去热水瓶胆内壁的水垢[Mg(OH)2与 CaCO3的混合物] C、骨质疏松、佝偻病患者可在医生指导下服用钙片治疗 D、新装修的房间内,常用炭包(装有活性炭)来除去甲醛等有害气体3. 人体摄入锌不足会引起各种疾病,缺锌者可在医生指导下通过服用葡萄糖酸锌口服液来补锌。已知葡萄糖酸锌的化学式为C12H22O14Zn。下列说法正确的是( )A、葡萄糖酸锌是由四种元素组成的 B、葡萄糖酸锌的式量是455g C、一个葡萄糖酸锌分子含有48个原子 D、葡萄糖酸锌属于有机高分子化合物4. 科学家发现一种新金属。根据表中信息推测其用途错误的是( )熔点
密度
强度
导电性
导热性
抗腐蚀性
2500℃
3g/cm3
与钢相似
良好
良好
优异
A、用于焊接金属 B、制造航天飞机 C、制外科手术刀 D、用于通讯设备5. 下列物质能通过金属和稀盐酸一步反应制得的是( )A、氯化铝 B、氯化铁 C、氯化铜 D、氯化银6. 下列现象和事实,可用金属活动性顺序作出合理解释的是( )①金属镁在空气中比铝更易点燃,说明镁比铝活动性强;
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强;
③硫酸铜、石灰乳配制农药波尔多液,不宜用铁制容器;
④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。
A、①② B、③④ C、①③④ D、①②③④7. 世界每年因锈蚀而损失的金属数量巨大,防止金属锈蚀已成为科学研究中的重大问题。下列有关金属锈蚀与保护措施中,不正确的是( )A、在铁表面刷油漆可以防止铁锈蚀 B、及时擦干被雨水淋湿的自行车可以防止自行车生锈 C、铝的抗锈蚀件能比铁强,生活中可用钢丝球洗刷铝锅 D、铁锈蚀的实质是铁与空气中的氧气、水蒸气等发生了化学变化8. 下列各组物质中符合“酸、碱、盐、氧化物”顺序的是( )A、H2SO4、Na2O、MgCl2、CO2 B、NaHSO4、Ba(OH)2、Na2CO3、ZnS C、HNO3、KOH、Na2CO3、O2 D、HCl、KOH、Na2CO3、MnO29. 三国时的“红脸”关云长与北宋时的“黑脸”包公本是互不相干的著名历史人物,一首描述某一化学实验过程的诗将两人联系在一起,诗的内容如下:“包公静卧水晶房,轻风迎面喜洋洋,忽然一阵烈火起,烧得包公变云长,云长急令退烈火,只留轻风吹暖房。”诗中的“包公”是指黑色CuO粉末,“云长”指的是红色的铜,则轻风是指( )A、C B、CO2 C、O2 D、H210.炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如图所示:
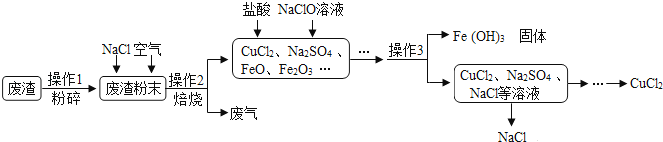
下列有关说法错误的是( )
A、操作1中粉碎的目的是增大反应物接触面积 B、操作2中,CuS、NaCl和O2在高温条件下反应生产CuCl2和Na2SO4 . 化学方程式为CuS+2NaCl+2O2 CuCl2+Na2SO4
C、操作3的名称是过滤
D、流程图中能循环利用的物质是NaCl和Na2SO4
11. 分离、提纯是化学实验的重要环节,下列实验设计不能达到实验目的是( )
CuCl2+Na2SO4
C、操作3的名称是过滤
D、流程图中能循环利用的物质是NaCl和Na2SO4
11. 分离、提纯是化学实验的重要环节,下列实验设计不能达到实验目的是( )实验目的
实验设计
A
除去CO中的少量H2O和CO2
先通过浓硫酸,再通过氢氧化钠溶液
B
除去NaCl固体中的少量Na2CO3
先加足量水溶解,再加适量稀盐酸,蒸发结晶
C
除去KNO3溶液中的少量K2SO4
加入适量的Ba(NO3)2溶液,过滤
D
除去铜粉中混有的少量铁粉
用磁铁吸引
A、A B、B C、C D、D12.甲乙丙丁四种物质的转化关系如图所示.下列说法正确的是( )
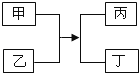 A、若丙为沉淀,则甲、乙中一定有一种物质是碱 B、若丙为气体,则甲、乙中一定有单质 C、若丁为水,则该反应一定是复分解反应 D、若甲、丁为单质,则该反应一定是置换反应13. 下列实验过程中与图象描述相符的一组是( )A、两份等质量、等溶质质量分数的双氧水溶液在有无MnO2的情况下产生
A、若丙为沉淀,则甲、乙中一定有一种物质是碱 B、若丙为气体,则甲、乙中一定有单质 C、若丁为水,则该反应一定是复分解反应 D、若甲、丁为单质,则该反应一定是置换反应13. 下列实验过程中与图象描述相符的一组是( )A、两份等质量、等溶质质量分数的双氧水溶液在有无MnO2的情况下产生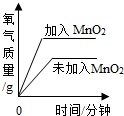 B、向等质量的镁、锌中分别加入稀盐酸
B、向等质量的镁、锌中分别加入稀盐酸 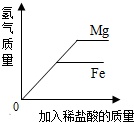 C、向一定质量的稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液
C、向一定质量的稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液 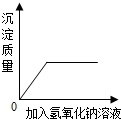 D、室温下,向一定质量的饱和石灰水中加入氧化钙
D、室温下,向一定质量的饱和石灰水中加入氧化钙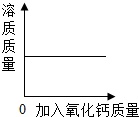 14. 向一定质量的AgNO3、Fe(NO3)2混合溶液中加入a g Zn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得质量仍为a g 。下列说法正确的是( )A、滤液一定呈无色 B、滤液中一定含Fe(NO3)2和Zn(NO3)2 C、滤渣中一定含Fe D、滤渣滴加稀盐酸一定无气泡产生15. 分别将下列各组物质同时加入水中,能得到无色透明溶液的是( )A、KCl、NaOH、CuSO4 B、Na2CO3、Ca(OH)2、NaNO3 C、NaOH、KNO3、NaCl D、Ba(NO3)2、K2SO4、NaCl
14. 向一定质量的AgNO3、Fe(NO3)2混合溶液中加入a g Zn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得质量仍为a g 。下列说法正确的是( )A、滤液一定呈无色 B、滤液中一定含Fe(NO3)2和Zn(NO3)2 C、滤渣中一定含Fe D、滤渣滴加稀盐酸一定无气泡产生15. 分别将下列各组物质同时加入水中,能得到无色透明溶液的是( )A、KCl、NaOH、CuSO4 B、Na2CO3、Ca(OH)2、NaNO3 C、NaOH、KNO3、NaCl D、Ba(NO3)2、K2SO4、NaCl二、填空题
-
16. 国家发布的“限塑令”于2008年6月1日开始实施。市售塑料袋有的用聚乙烯[(CH2CH2)n]制成,有的用聚氯乙烯[(CH2CHCl)n]制成,请回答:(1)、聚氯乙烯由种元素组成。(2)、通过点燃的方法可以鉴别聚乙烯和聚氯乙烯,如果塑料购物袋点燃时有强烈的刺激性气味,这种塑料购物袋可能是由制成。(3)、实行塑料购物袋有偿使用的意义是____(可多选,填字母)。A、节约资源 B、避免滥用塑料袋 C、保护生态环境 D、提高生活水平17. 近年我省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措,我区街头垃圾桶如图所示,回答下列问题:
 (1)、图中标示的物质中,属于金属材料的是(写出1种)(2)、塑料矿泉水瓶应放入(填“可回收”或“不可回收”)筒中.(3)、内筒铝合金具有密度小,硬度大,具有一定的抗腐蚀等特性。但需要恰当使用,如铝与稀盐酸易反应:2Al+6HCl=2AlCl3+3H2↑,该反应属于化学反应基本类型中的。18.
(1)、图中标示的物质中,属于金属材料的是(写出1种)(2)、塑料矿泉水瓶应放入(填“可回收”或“不可回收”)筒中.(3)、内筒铝合金具有密度小,硬度大,具有一定的抗腐蚀等特性。但需要恰当使用,如铝与稀盐酸易反应:2Al+6HCl=2AlCl3+3H2↑,该反应属于化学反应基本类型中的。18.某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
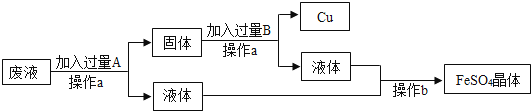
(1)操作a的名称是 , 该操作中用到的玻璃仪器有 . 操作b的名称是 .
(2)写出流程中有关反应的化学方程式: .
19.请你猜猜我是谁:
如图牵手表示在一定条件下会发生化学反应.A、B、C、D、E分别是木炭、氧化铁、二氧化碳、稀盐酸、氢氧化钠中的一种物质,其中C是碱,E具有吸附性.

(1)A ,B ,C .
(2)A和B反应的化学方程式是 .
(3)牵手时,能生成盐和水的反应共有 个,A和E (填“能”或“不能”)牵手.
20. 有一固体混合物质可能含有硫酸钾、硝酸铵、氯化钡中的一种或几种,现需要对此物质成分进行检测。甲同学向该固体混合物中加入足量的水,形成无色溶液;乙同学向该固体混合物中加入足量氢氧化钡溶液,产生白色沉淀,并放出刺激性气体。(1)、该气体为(填名称)。(2)、根据两同学的实验现象可推定此固体混合物质的组成是。21. 1799年法国化学家普罗斯与贝托雷进行了一场经典的化学论战。普罗斯认为化合物都有固定的组成,而贝托雷认为一种物质可以与另一种能和它化合的物质以一切比例相化合。(1)、当今科学观点中,以下物质属于化合物的是 。A、纯净的空气 B、盐酸溶液 C、氧气 D、二氧化碳气体(2)、以下证据中支持普罗斯观点的有 。A、铜、铅、锡等金属在空气中加热可以连续吸收氧气,得到一系列氧化物 B、某些化学反应是可逆的,反应物的质量决定了生成物的产率 C、秘鲁的氯化银和西伯利亚的氯化银各元素组成比完全相同 D、硫化铁中铁含量可以在63.5%到60.1%变化 E、当金属与氧化合时,一般常见的只生成两种化合物,而且每一种都有固定组成。 F、天然化合物与人造化合物有相同的组成22. 如图为铁钉的一系列变化,据图回答问题。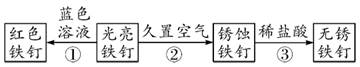 (1)、①中铁钉变红的原因。(2)、③中除去铁锈的化学方程式为。(3)、如果用a、b、c分别代表光亮铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为(用字母表示)。
(1)、①中铁钉变红的原因。(2)、③中除去铁锈的化学方程式为。(3)、如果用a、b、c分别代表光亮铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为(用字母表示)。三、实验探究题
-
23.
如图是某化学课外学习小组设计的探究工业炼铁原理及产物验证的实验,其中A装置的作用是将二氧化碳和炭粉在高温下转化为一氧化碳,看图回答下列问题:
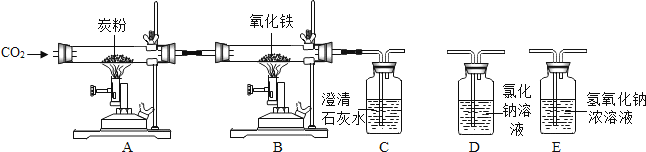 (1)、写出装置A玻璃管中发生反应的化学方程式: ;(2)、实验过程中,应先点燃 装置中的酒精喷灯.(3)、要验证B中产生的CO2 , 还需要在A、B之间增加 装置(填“D”或“E”).(4)、整套装置还有一个明显的不足之处是: .(5)、由于铁的氧化物Fe3O4和FeO均为黑色,B中得到的铁是否含有Fe3O4和FeO,该小组同学设计了下列探究实验.
(1)、写出装置A玻璃管中发生反应的化学方程式: ;(2)、实验过程中,应先点燃 装置中的酒精喷灯.(3)、要验证B中产生的CO2 , 还需要在A、B之间增加 装置(填“D”或“E”).(4)、整套装置还有一个明显的不足之处是: .(5)、由于铁的氧化物Fe3O4和FeO均为黑色,B中得到的铁是否含有Fe3O4和FeO,该小组同学设计了下列探究实验.【提出问题】CO还原Fe2O3得到的铁是否含有Fe3O4和FeO?
【提出猜想】猜想1:Fe; 猜想2:Fe和Fe3O4; 猜想3:Fe和FeO;
猜想4: .
【查阅资料】①2FeCl3+Fe=3FeCl2 , 但FeCl3溶液不与Fe3O4、FeO反应
②Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
③含有Fe3+盐溶液遇到KSCN溶液时变成血红色.
【实验探究】限选试剂:CO、盐酸、澄清石灰水、KSCN溶液、FeCl3溶液
实验操作
实验现象
实验结论
Ⅰ.取少量黑色产物加入到装有FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤.
黑色固体部分溶解
猜想2和猜想4都不成立
Ⅱ.取第I步洗涤后所得固体加入到装有足量
的试管中,充分反应后,再滴加少量KSCN溶液.
黑色固体全部溶解,溶液不变为血红色
Ⅲ.另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量澄清石灰水的容器中.
澄清石灰水变浑浊
猜想 成立二氧化碳的化学性质
24.由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。
 (1)、仪器E中的现象。仪器E中所发生的反应化学方程式为。(2)、仪器B的作用是。(3)、若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重ag,则Wg该塑料试样中含氢元素的质量为g(计算结果可为分数形式)。
(1)、仪器E中的现象。仪器E中所发生的反应化学方程式为。(2)、仪器B的作用是。(3)、若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重ag,则Wg该塑料试样中含氢元素的质量为g(计算结果可为分数形式)。
(4)、若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果(填“偏小”“偏大”或“无影响”中之一)。(5)、碱石灰的成分是氢氧化钠和氧化钙,则装置连接正确时F装置的作用是。25. “不用火、不用电,只需一瓶水,就能享用美食”。自热食品的发热原理是发热包和水发生化学反应,遇水后在3到5秒内即刻升温,温度高达150℃以上。兴趣小组想了解发热包的成分,他们找来某品牌自热食品,取出发热包打开后,发现呈黑色粉末状固体。查询相关资料后发现,发热包可能含有铁粉、活性炭、生石灰、碳酸钠、氯化钠等成分。根据所学的知识,发热的原因最有可能是发热包中的和水发生化学反应。
【猜测】小组成员通过讨论,对发热包的成分进行了猜测。
【实验】①若要证明发热包中存在铁粉,请帮助小组成员设计相关实验方案:。
②取发热包中固体置于烧杯中,并加入适量的水,取上层清液于试管中,滴加硝酸发现试管中有白色沉淀出现,说明物质中有氯化钠。
③在步骤②烧杯剩余物质中,滴加足量 , 发现烧杯中产生气泡,将气体通入澄清石灰水,石灰水变浑浊,说明物质中含有碳酸钠。
【结论】查阅资料后发现,发热包中肯定含有铁粉、生石灰、碳酸钠、氯化钠。
【反思】小组另一名成员仔细观察后发现,在步骤②时,不仅产生了白色沉淀,还出现了少量气泡,经讨论后觉得步骤③是没有必要的,仅通过步骤②也可以确定步骤②中上层清液所含溶质有。
四、解答题
-
26. 金属的物理性质和化学性质决定了金属的用途,观察日常生活中的一些现象,请思考并完成下列问题:(1)、小明在观察母亲烧菜时,发现在炒蔬菜时,母亲用的是铝锅;在做酸菜鱼汤时,用的是铁锅.小明不知其何故,你知道什么原因吗?(2)、家里的铁制菜刀,用过后如果没有清洗,第二天刀刃上就长了很多红色的“铁锈”;铝盆广泛用作各种炊具,但如果你把咸菜或用铝盆腌制蔬菜,蔬菜还没有腌制好铝盆却已经漏水了.试分析原因.(3)、用铁锅炒菜,有利于身体健康.世界卫生组织经过缜密调查后向全世界推荐使用中国的铁锅.如果在烹制菜肴时,适当加入食醋效果更好;而有些麦片中加入少量铁粉,用于人体补铁.
根据你学过的基本化学知识,试分析上述情况下蕴含的化学知识.
27. 2020年4月,国家药监局下发的《药品补充申请批件》显示,连花清瘟胶囊(颗粒)被批准可用于新冠病毒性肺炎轻型引起的发热、咳嗽、乏力,根据化合物的光谱分析发现连花清瘟胶囊总浸膏中含有连翘脂素(C29H36O15)等18个化合物,请通过分析计算回答下列问题(1)、连翘脂素属于。(填“无机物或有机物”)(2)、连翘脂素中碳、氢、氧三种元素的原子个数比为。(3)、312g连翘脂素中碳元素质量。28. 为探究铜及其化合物的性质, 进行如下实验:称取已部分被H,还原的氧化铜粉末(含Cu和CuO)7.2g置于烧杯中,向其中加入50g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。请分析计算: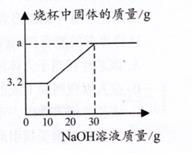 (1)、加完50克稀硫酸后溶液中的溶质为(写出化学式);(2)、Cu和CuO的混合物中,Cu元素和O元素的质量比为;(3)、a的值;(4)、实验所用稀硫酸中溶质的质量分数。29. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
(1)、加完50克稀硫酸后溶液中的溶质为(写出化学式);(2)、Cu和CuO的混合物中,Cu元素和O元素的质量比为;(3)、a的值;(4)、实验所用稀硫酸中溶质的质量分数。29. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示: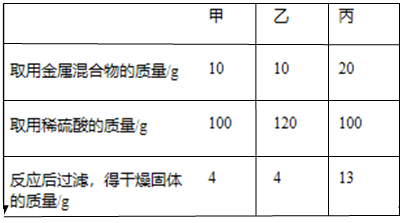
数据,回答下列问题:
(1)、丙同学所得混合物中铜的质量是。(2)、甲所得溶液中含有溶质的是。(3)、根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为。(4)、计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)30. 如图所示,是小科建构的铜及其化合物之间相互转化的关系图。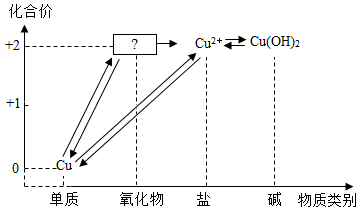 (1)、写出图中“?”处物质的化学式。(2)、要一步实现图中“Cu→Cu2”的转化,可将铜加入适量的某种盐溶液中,则该溶液的溶质是。(3)、根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方案,要求写出主要操作步骤及所需要的试剂。31. 某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。(已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
(1)、写出图中“?”处物质的化学式。(2)、要一步实现图中“Cu→Cu2”的转化,可将铜加入适量的某种盐溶液中,则该溶液的溶质是。(3)、根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方案,要求写出主要操作步骤及所需要的试剂。31. 某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。(已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)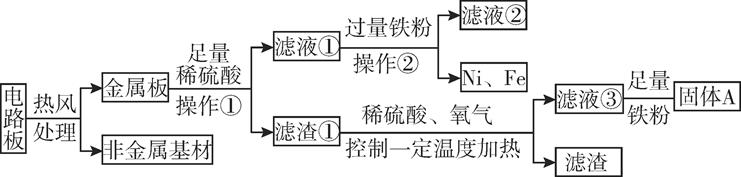 (1)、操作①的名称是 , 写出滤液②中金属阳离子符号:。(2)、写出滤液③和铁粉发生反应的一个化学方程式:。(3)、写出固体A的成分: , Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是。(4)、回收过程中需要过量铁粉,滤液①中加入过量铁粉的目的是 , 工业上高炉炼铁的原理是(用化学方程式表示) , 铁锭可以轧成铁板,体现了金属的性。32. 将等质量的锌粉和镁粉,分别放入质量相等的19.6%稀硫酸中,当酸过量时生成氢气质量随反应时间变化的曲线如甲图所示,当金属过量时生成氢气质量随反应时间变化的曲线如乙图所示,请回答:
(1)、操作①的名称是 , 写出滤液②中金属阳离子符号:。(2)、写出滤液③和铁粉发生反应的一个化学方程式:。(3)、写出固体A的成分: , Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是。(4)、回收过程中需要过量铁粉,滤液①中加入过量铁粉的目的是 , 工业上高炉炼铁的原理是(用化学方程式表示) , 铁锭可以轧成铁板,体现了金属的性。32. 将等质量的锌粉和镁粉,分别放入质量相等的19.6%稀硫酸中,当酸过量时生成氢气质量随反应时间变化的曲线如甲图所示,当金属过量时生成氢气质量随反应时间变化的曲线如乙图所示,请回答: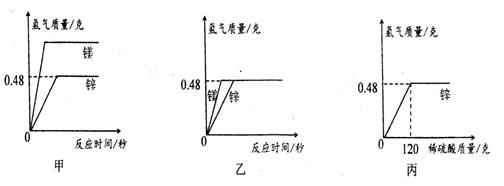 (1)、下列对于甲乙两图理解的说法正确的是 (可多选)。A、甲图中反应结束后两种金属可能都有剩余 B、乙图中反应结束后稀硫酸可能都没有剩余 C、甲图中反应结束后消耗两种金属的质量相等 D、乙图中反应结束后生成氢气的质量相等(2)、在丙图上画出镁粉与足量稀硫酸反应产生氢气的质量与稀硫酸质量的关系图(写出计算过程,并要求在图中标出曲线中必要的数据) 。(Mg+H2SO4=MgSO4+H2↑;Zn+H2SO4=ZnSO4+H2↑)
(1)、下列对于甲乙两图理解的说法正确的是 (可多选)。A、甲图中反应结束后两种金属可能都有剩余 B、乙图中反应结束后稀硫酸可能都没有剩余 C、甲图中反应结束后消耗两种金属的质量相等 D、乙图中反应结束后生成氢气的质量相等(2)、在丙图上画出镁粉与足量稀硫酸反应产生氢气的质量与稀硫酸质量的关系图(写出计算过程,并要求在图中标出曲线中必要的数据) 。(Mg+H2SO4=MgSO4+H2↑;Zn+H2SO4=ZnSO4+H2↑)