浙江省宁波市七校2019-2020学年九年级上学期科学第一阶段测试卷(前三章)
试卷更新日期:2020-10-16 类型:月考试卷
一、选择题(本题共15小题,1~ 10小题,每题4分,11~15小题,每题3分,共55分。请选出每小题中一个符合题意的选项,不选、错选、多选均不给分。)
-
1. 图是某同学测量几种食品的pH后绘制的图象,其中偏碱性的是( )
 A、腌萝卜 B、南瓜 C、莴苣 D、甜玉米2. 实验基本操作是学习化学的灵魂。图所示的“错误操作",与相对应选项的“可能产生后果”不一致的是( )A、标签受损
A、腌萝卜 B、南瓜 C、莴苣 D、甜玉米2. 实验基本操作是学习化学的灵魂。图所示的“错误操作",与相对应选项的“可能产生后果”不一致的是( )A、标签受损 B、读数偏小
B、读数偏小  C、污染待测液
C、污染待测液  D、液体飞溅
D、液体飞溅  3. 将一定量的浓硫酸和浓盐酸分别敞口放置在空气中一段时间后,下列说法正确的是( )A、溶液的质量都增加 B、溶液的质量都减少 C、溶液的溶质质量分数都减小 D、溶液的溶质质量分数都增大4. 下表是某指示剂在一定pH范围内所显示的颜色:向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )
3. 将一定量的浓硫酸和浓盐酸分别敞口放置在空气中一段时间后,下列说法正确的是( )A、溶液的质量都增加 B、溶液的质量都减少 C、溶液的溶质质量分数都减小 D、溶液的溶质质量分数都增大4. 下表是某指示剂在一定pH范围内所显示的颜色:向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )颜色
红
橙
绿
蓝
紫
pH范围
1~3
4~5
6~7
8~10
11~14
A、由红变紫 B、由蓝变绿 C、由绿变橙 D、由蓝变紫5. 如图所示是一个化学反应的微观模型图,其中“ ”和“O”分别表示两种原子,甲、乙分别表示反应前和反应后的物质,下列说法中错误的是( )
”和“O”分别表示两种原子,甲、乙分别表示反应前和反应后的物质,下列说法中错误的是( )  A、该反应的生成物均为单质 B、该反应可能为水的电解 C、反应生成的两种分子个数之比为5:1 D、该反应属于分解反应6. 宁波盛产杨梅。杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6。下列有关叶酸的说法中正确的是( )A、叶酸的相对分子质量为441g B、叶酸中氮元素的质量分数大于氧元素的质量分数 C、叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6 D、叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成7. 如图所示,有下列四种实验设计及操作,实验过程中其现象不足以说明CO2与NaOH溶液发生了反应的是( )A、
A、该反应的生成物均为单质 B、该反应可能为水的电解 C、反应生成的两种分子个数之比为5:1 D、该反应属于分解反应6. 宁波盛产杨梅。杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6。下列有关叶酸的说法中正确的是( )A、叶酸的相对分子质量为441g B、叶酸中氮元素的质量分数大于氧元素的质量分数 C、叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6 D、叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成7. 如图所示,有下列四种实验设计及操作,实验过程中其现象不足以说明CO2与NaOH溶液发生了反应的是( )A、 B、
B、 C、
C、 D、
D、 8. 除去下列各物质中混有的少量杂质,所用的试剂或操作不合理的是( )
8. 除去下列各物质中混有的少量杂质,所用的试剂或操作不合理的是( )选项
物质
杂质
试剂、方法
A
氮气
氧气
木条,点燃
B
稀硝酸
稀盐酸
加入适量的硝酸银溶液,过滤
C
氢氧化钠溶液
氢氧化钡溶液
加入适量的碳酸钠溶液,过滤
D
氧化铜
铜粉
空气中灼烧
A、A B、B C、C D、D9. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:①白色片状固体 ②有腐蚀性 ③易吸收水分而潮解 ④易溶于水,溶解放热 ⑤能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( )A、①② B、①②③ C、②③④ D、③⑤10. 在“欢迎来找茬”的趣味活动中,老师举出四个错误实例,在学生的错因分析中错误的是( )序号
错误实例
错因分析
A
铁与稀硫酸反应生成硫酸铁
反应产物不正确
B
FeCl3+3NaOH=Fe(OH)3+NaCl
只缺少沉淀符号
C
2H2O=2H2↑+O2↑
反应条件不正确
D
氢氧化钠俗名烧碱或纯碱
俗名纯碱不正确
A、A B、B C、C D、D11. 下列各组离子在溶液中能大量共存的是( )A、Ca2+ Cl- Na+ B、Cu2+ K+ OH- C、H+ Na+ D、K+ Na+12. 实验小组用传感器探究氢氧化钠溶液与稀盐酸反应过程中温 度和pH的变化。测定结果如图所示。下列说法不正确的( )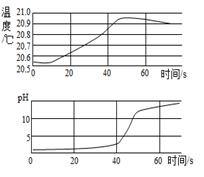 A、反应过程中有热量放出 B、30s时,溶液中溶质为HCl和NaCl C、该实验是将稀盐酸滴到稀NaOH溶液中 D、从20s到40s,溶液的温度升高,pH增大13. 在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质量如表。下列说法正确的是( )
A、反应过程中有热量放出 B、30s时,溶液中溶质为HCl和NaCl C、该实验是将稀盐酸滴到稀NaOH溶液中 D、从20s到40s,溶液的温度升高,pH增大13. 在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质量如表。下列说法正确的是( )物质
X
O2
CO2
H2O
反应前的质量/g
19
34
6
2
反应后的质量/g
11
待测
28
20
A、表中的待测值为32 B、X中一定含有C、H、O元素 C、该反应为置换反应 D、反应中CO2和H2O的质量比为11:914. 图装置可用于气体的收集、检验、除杂和体积的测量等,不能完成的实验是( ) A、气体从a端通入,收集氧气 B、瓶内装有澄清石灰水,检验氧气中是否混有二氧化碳 C、瓶内装有氢氧化钠溶液,吸收一氧化碳中混有的二氧化碳 D、在b端接量筒,瓶内装满水,测量气体的体积15. 下列图象(如图所示)与所对应操作相符的是( )
A、气体从a端通入,收集氧气 B、瓶内装有澄清石灰水,检验氧气中是否混有二氧化碳 C、瓶内装有氢氧化钠溶液,吸收一氧化碳中混有的二氧化碳 D、在b端接量筒,瓶内装满水,测量气体的体积15. 下列图象(如图所示)与所对应操作相符的是( ) A、用两份等质量、等质量分数的过氧化氢溶液制取氧气 B、向一定质量分数的盐酸中不断加水 C、向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 D、向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液
A、用两份等质量、等质量分数的过氧化氢溶液制取氧气 B、向一定质量分数的盐酸中不断加水 C、向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 D、向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液二、填空题(共6小题,每空2分,共36分)
-
16. 硫酸、盐酸是重要的化工原料。(1)、浓硫酸在实验室常用作干燥剂,是因为浓硫酸有性。(2)、98%的浓硫酸稀释为稀硫酸时,一定要将沿烧杯壁缓慢地注入盛有的烧杯里,并用搅拌。(3)、盐酸在下列用途中,不能用硫酸代替盐酸的是(填编号)
① 金属表面除锈 ② 制造药物氯化锌 ③除去NaCl中的少量NaOH
17. 常温下,氯酸钾的溶解度较小,在工业上可通过图转化制得。 (1)、在反应Ⅰ中,通电时发生的反应方程式为NaCl+3X NaClO3+3H2↑,则X的化学式为。(2)、反应Ⅱ的基本反应类型为。(3)、该转化中可以循环利用的物质是(填名称)18. 小科利用如图所示装置,做NaHCO3受热分解的实验。
(1)、在反应Ⅰ中,通电时发生的反应方程式为NaCl+3X NaClO3+3H2↑,则X的化学式为。(2)、反应Ⅱ的基本反应类型为。(3)、该转化中可以循环利用的物质是(填名称)18. 小科利用如图所示装置,做NaHCO3受热分解的实验。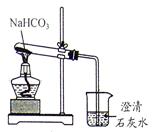 (1)、加热一段时间后,观察到烧杯中的澄清石灰水变;(2)、实验结束时的正确操作是 (填字母)。A、先将导管移出液体,再熄灭酒精灯 B、先熄灭酒精灯,再将导管移出液体19. 金属材料在生产生活中有广泛的用途,人类的生产生活离不开金属。(1)、铜制插头,这是利用金属铜的;(2)、铁制品易锈蚀,工厂用稀硫酸除去铁锈的原理。(用化学方程式表示)20. 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示。请回答:甲是 , 乙是 ,丁是。
(1)、加热一段时间后,观察到烧杯中的澄清石灰水变;(2)、实验结束时的正确操作是 (填字母)。A、先将导管移出液体,再熄灭酒精灯 B、先熄灭酒精灯,再将导管移出液体19. 金属材料在生产生活中有广泛的用途,人类的生产生活离不开金属。(1)、铜制插头,这是利用金属铜的;(2)、铁制品易锈蚀,工厂用稀硫酸除去铁锈的原理。(用化学方程式表示)20. 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示。请回答:甲是 , 乙是 ,丁是。 21. 为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实验,请根据图回答问题:
21. 为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了下面两个实验,请根据图回答问题: (1)、甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针会发生偏转吗?并说明理由。。(2)、两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在装置中进行。(3)、从微观角度分析,在化学反应前后一定不变的是(选填序号)。
(1)、甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针会发生偏转吗?并说明理由。。(2)、两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在装置中进行。(3)、从微观角度分析,在化学反应前后一定不变的是(选填序号)。①原子种类
②分子种类
③原子数目
④分子质量
⑤分子数目
⑥原子质量
三、实验探究题(共4小题,每空3分,共39分)
-
22. 如图所示,一根用细绳吊着的长玻璃棒左端绕上光亮的粗铜丝,并使玻璃棒保持水平。用酒精灯给铜丝加热数分钟,停止加热后冷却,发现玻璃棒左端下降。
 (1)、用化学方程式表示左端下降的原因:。(2)、将玻璃棒连同细绳取下,铜丝端浸入稀硫酸,充分反应后取出,洗涤、干燥再重图新吊起(细绳系在玻璃棒的位置不变),玻璃棒(选填“能”或“不能”)再次保持水平。23. 图是研究实验室制取氧气的装置图,请按要求回答下列问题。
(1)、用化学方程式表示左端下降的原因:。(2)、将玻璃棒连同细绳取下,铜丝端浸入稀硫酸,充分反应后取出,洗涤、干燥再重图新吊起(细绳系在玻璃棒的位置不变),玻璃棒(选填“能”或“不能”)再次保持水平。23. 图是研究实验室制取氧气的装置图,请按要求回答下列问题。 (1)、实验室用高锰酸钾制取氧气,应选用的发生装置是(填字母符号,下同),若要收集一瓶干燥的氧气,应选择的收集装置是。(2)、实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水。制取并收集NH3 , 应该从上图中选择的制取装置是。24. 某同学针对氧化钙设计了图的实验方案:
(1)、实验室用高锰酸钾制取氧气,应选用的发生装置是(填字母符号,下同),若要收集一瓶干燥的氧气,应选择的收集装置是。(2)、实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小。NH3极易溶于水。制取并收集NH3 , 应该从上图中选择的制取装置是。24. 某同学针对氧化钙设计了图的实验方案: (1)、A中发生反应的化学方程式为;(2)、如果要证明C中不是水而是一种溶液,可选择下列 (填序号)进行实验。
(1)、A中发生反应的化学方程式为;(2)、如果要证明C中不是水而是一种溶液,可选择下列 (填序号)进行实验。①稀盐酸②酚酞溶液③二氧化碳④氯化钠溶液
(3)、操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是。25. 某兴趣小组在整理实验室时发现一瓶敞口放置的氢氧化钠固体,于是他们对这瓶氢氧化钠固体的成分展开探究。[提出问题]这瓶氢氧化钠固体是否变质?
[猜想假设]猜想一:没有变质,全部是NaOH;
猜想二:完全变质,全部是Na2CO3;
猜想三:。
[实验探究]为了探究固体成分,他们分别进行了如下实验:
⑴甲同学取少量固体于试管中,加水后有放热现象,说明这瓶固体中含有。
⑵写出氢氧化钠变质的化学方程式 。
⑶为了进一步确定这瓶固体的成分,丙同学设计了如下方案,请你完成下列实验报告:
实验步骤
可能观察到的现象
结论
Ⅰ、取样于试管中,加水溶解,滴入过量的(填化学式)溶液
产生白色沉淀
含有Na2CO3
Ⅱ、反应后过滤,取上层清液,滴人酚酞溶液
无色酚酞溶液变红
猜想正确
四、解答题(共7小题,第26、28、29、31题各6分,第27、30题8分,第32题10分,共50分)
-
26. 芯片是所有电脑、“智 能家电”的核心部件,它是以高纯度的单质硅(硅的元素符号为Si)为材料制成的。用化学方法制得高纯硅的反应原理为:
①SiO2+2C Si+2CO↑
②Si+2Cl2 SiCl4
③SiCl4+2H2 Si+4HCl
(1)、上述反应中基本反应类型有种;(2)、在物质类别中,SiO2属于化合物中的 , 其中的硅元素的化合价为。27. 钙是维持人体正常功能所必须的元素,有时需要服用补钙满足人体需求。图分别为两种补钙剂说明书的一部分。请根据图示中的信息回答下列问题: (1)、钙是人体必需的常量元素,每日要摄取足够量的钙,才能避免 ;(填字母序号)A、佝偻病或骨质疏松症 B、贫血症 C、甲状腺肿大(2)、葡萄糖酸钙(C12H22O14Ca)的化学式量是;(3)、碳酸钙(化学式为CaCO3)中钙元素的质量分数为;(4)、每片金钙尔奇中含碳酸钙的质量为mg;28. 丁酸乙酯是一种无色、具有菠萝香味的液体,常用作食品、饮料的调香剂。其分子结构为C6H12Ox。(1)、丁酸乙酯是由种元素组成的;(2)、丁酸乙酯的相对分子质量为116,则x=;(3)、丁酸乙酯中氢元素和氧元素最简质量比等于。29. 如图所示,实验室用过氧化氢溶液和二氧化锰制取氧气。 气体发生装置内物质的总质量反应前 35.6g 反应后 32.4g。 回答下列问题:
(1)、钙是人体必需的常量元素,每日要摄取足够量的钙,才能避免 ;(填字母序号)A、佝偻病或骨质疏松症 B、贫血症 C、甲状腺肿大(2)、葡萄糖酸钙(C12H22O14Ca)的化学式量是;(3)、碳酸钙(化学式为CaCO3)中钙元素的质量分数为;(4)、每片金钙尔奇中含碳酸钙的质量为mg;28. 丁酸乙酯是一种无色、具有菠萝香味的液体,常用作食品、饮料的调香剂。其分子结构为C6H12Ox。(1)、丁酸乙酯是由种元素组成的;(2)、丁酸乙酯的相对分子质量为116,则x=;(3)、丁酸乙酯中氢元素和氧元素最简质量比等于。29. 如图所示,实验室用过氧化氢溶液和二氧化锰制取氧气。 气体发生装置内物质的总质量反应前 35.6g 反应后 32.4g。 回答下列问题: (1)、反应中二氧化锰的作用是 。(2)、反应生成氧气的质量为 g(3)、计算参加反应的过氧化氢的质量,写出必要的计算过程。30. 利用图装置制取并测定所收集氢气的体积。小科同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸,两者恰好完全反应。
(1)、反应中二氧化锰的作用是 。(2)、反应生成氧气的质量为 g(3)、计算参加反应的过氧化氢的质量,写出必要的计算过程。30. 利用图装置制取并测定所收集氢气的体积。小科同学在锥形瓶中装入13g锌粒,往长颈漏斗中加入100g稀硫酸,两者恰好完全反应。 (1)、图中装置采用的是法收集氢气;若要收集300mL氢气,应选用mL(填“10”或“100”或“500”)量筒;(2)、求稀硫酸中溶质的质量分数;(3)、反应后所得硫酸锌的质量。31. 实验室有一瓶标签被腐蚀的盐酸,小科为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
(1)、图中装置采用的是法收集氢气;若要收集300mL氢气,应选用mL(填“10”或“100”或“500”)量筒;(2)、求稀硫酸中溶质的质量分数;(3)、反应后所得硫酸锌的质量。31. 实验室有一瓶标签被腐蚀的盐酸,小科为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液。然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题: (1)、配制了8g10%的NaOH溶液,需要水的质量为 ;(2)、计算该盐酸的溶质质量分数;(写出计算过程)(3)、当滴入4g盐酸时,烧杯内溶液中钠元素的质量为 。32. 某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g放入烧杯,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。请计算:
(1)、配制了8g10%的NaOH溶液,需要水的质量为 ;(2)、计算该盐酸的溶质质量分数;(写出计算过程)(3)、当滴入4g盐酸时,烧杯内溶液中钠元素的质量为 。32. 某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g放入烧杯,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。请计算:序号
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
20
20
20
20
剩余固体的质量/g
11
6
2.8
n
(1)、如表中n的数值为;(2)、样品中碳酸钙的质量分数为;(3)、计算所用盐酸的溶质质量分数;(4)、计算第四次后所得溶液中氯化钙的质量分数。