浙江省宁波市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2020-09-17 类型:期末考试
一、单选题
-
1. 下列物质的化学式可用“Na2CO3”表示的是( )A、烧碱 B、纯碱 C、小苏打 D、熟石灰2. 垃圾分类有利于资源回收利用,下列垃圾分类错误的是( )
选项
A
B
C
D
垃圾
废金属
剩饭菜
过期药品
废塑料瓶
垃圾分类

可回收物

厨余垃圾

有害垃圾

其他垃圾
A、A B、B C、C D、D3. 以下仪器中,名称为“蒸馏烧瓶”的是( )A、 B、
B、 C、
C、 D、
D、 4. 下列分散质粒子直径在10- 9~10-7 m的分散系是( )A、稀盐酸 B、AgNO3溶液 C、酒精溶液 D、淀粉溶液5. 反应 4HCl+O2 2Cl2+2H2O中,氧化产物是( )A、HCl B、O2 C、Cl2 D、H2O6. 下列物质属于电解质的是( )A、CO2 B、食盐水 C、Mg D、CH3COOH7. 下列有关化学用语表示正确的是( )A、钠离子的结构示意图:
4. 下列分散质粒子直径在10- 9~10-7 m的分散系是( )A、稀盐酸 B、AgNO3溶液 C、酒精溶液 D、淀粉溶液5. 反应 4HCl+O2 2Cl2+2H2O中,氧化产物是( )A、HCl B、O2 C、Cl2 D、H2O6. 下列物质属于电解质的是( )A、CO2 B、食盐水 C、Mg D、CH3COOH7. 下列有关化学用语表示正确的是( )A、钠离子的结构示意图: B、乙烯的比例模型:
B、乙烯的比例模型:  C、中子数为18 的氯原子 Cl
D、苯的结构简式:C6H6
8. 下列说法正确的是( )A、CH4与C5H12互为同系物 B、14C 与14N 互为同位素 C、H2O 与 D2O互为同素异形体 D、
C、中子数为18 的氯原子 Cl
D、苯的结构简式:C6H6
8. 下列说法正确的是( )A、CH4与C5H12互为同系物 B、14C 与14N 互为同位素 C、H2O 与 D2O互为同素异形体 D、 与
与 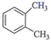 互为同分异构体
9. 下列说法正确的是( )A、二氧化碳可用作镁着火的灭火剂 B、工业上可以用电解饱和食盐水制取氯气 C、Cl2 能使湿润的有色布条褪色,说明 Cl2具有漂白性 D、我国华为AI 芯片已跻身于全球 AI 芯片榜单前列,该芯片的主要材料是二氧化硅10. 五种短周期元素在元素周期表中的位置如图所示,已知M原子最外层电子数是其电子层数的2倍,下列说法错误的是( )
互为同分异构体
9. 下列说法正确的是( )A、二氧化碳可用作镁着火的灭火剂 B、工业上可以用电解饱和食盐水制取氯气 C、Cl2 能使湿润的有色布条褪色,说明 Cl2具有漂白性 D、我国华为AI 芯片已跻身于全球 AI 芯片榜单前列,该芯片的主要材料是二氧化硅10. 五种短周期元素在元素周期表中的位置如图所示,已知M原子最外层电子数是其电子层数的2倍,下列说法错误的是( ) A、原子半径:Z>X>Y B、X和M 都能与Y形成两种常见的化合物 C、氢化物的稳定性:N<M D、工业上可以用X 单质与ZY2反应制得Z 单质11. 下列反应的离子方程式正确的是( )A、金属钠与水反应: Na+2H2O=Na++2OH- +H2↑ B、MgCl2 溶液与过量氨水反应:Mg2++2OH-=Mg(OH)2↓ C、氯化铁溶液腐蚀铜片:2Fe3++Cu=2Fe2++ Cu2+ D、硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO =BaSO4↓12. 下列有关物质分离、提纯的说法正确的是( )
A、原子半径:Z>X>Y B、X和M 都能与Y形成两种常见的化合物 C、氢化物的稳定性:N<M D、工业上可以用X 单质与ZY2反应制得Z 单质11. 下列反应的离子方程式正确的是( )A、金属钠与水反应: Na+2H2O=Na++2OH- +H2↑ B、MgCl2 溶液与过量氨水反应:Mg2++2OH-=Mg(OH)2↓ C、氯化铁溶液腐蚀铜片:2Fe3++Cu=2Fe2++ Cu2+ D、硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO =BaSO4↓12. 下列有关物质分离、提纯的说法正确的是( ) A、利用装置①, 分离汽油和煤油 B、利用装置②,分离蔗糖和食盐 C、利用装置③,用溴水除去甲烷中的乙烯 D、利用装置④,用乙醇提取碘水中的碘13. 下列说法正确的是( )A、石油裂化的目的是为了提高轻质油的产量和质量 B、煤的液化、气化和石油的分馏都属于物理变化 C、为了有效利用生物质能,可以将植物的秸杆直接燃烧获得沼气 D、氢气被称为“绿色能源” ,利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向14. 下列说法正确的是( )A、糖类、蛋白质和油脂都是有机高分子化合物 B、利用油脂的皂化反应可以制造肥皂 C、鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清因盐析而凝聚 D、淀粉水解液加过量氢氧化钠溶液后,加新制氢氧化铜悬浊液可检验是否水解完全15. 燃料电池是一种高效的供能装置,如图是甲烷燃料电池原理示意图,电池工作时,下列有关说法错误的是( )
A、利用装置①, 分离汽油和煤油 B、利用装置②,分离蔗糖和食盐 C、利用装置③,用溴水除去甲烷中的乙烯 D、利用装置④,用乙醇提取碘水中的碘13. 下列说法正确的是( )A、石油裂化的目的是为了提高轻质油的产量和质量 B、煤的液化、气化和石油的分馏都属于物理变化 C、为了有效利用生物质能,可以将植物的秸杆直接燃烧获得沼气 D、氢气被称为“绿色能源” ,利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向14. 下列说法正确的是( )A、糖类、蛋白质和油脂都是有机高分子化合物 B、利用油脂的皂化反应可以制造肥皂 C、鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清因盐析而凝聚 D、淀粉水解液加过量氢氧化钠溶液后,加新制氢氧化铜悬浊液可检验是否水解完全15. 燃料电池是一种高效的供能装置,如图是甲烷燃料电池原理示意图,电池工作时,下列有关说法错误的是( )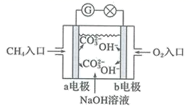 A、a电极发生氧化反应 B、b电极是电源的正极 C、电子由a电极经外电路向b电极移动,再经电解质溶液回到a电极 D、b极电极反应式为:O2+ 2H2O + 4e-=4OH-16. 下列说法正确的是( )A、氯化钠晶体熔融时需要克服离子键 B、石英和干冰都属于原子晶体 C、CH4、CO2中所有原子均满足最外层8 电子稳定结构 D、KOH和 CaCl2 都是含有共价键的离子化合物17. 反应CO(g)+ 2H2(g)=CH3OH(g) 的能量变化如图所示,下列说法正确的是( )
A、a电极发生氧化反应 B、b电极是电源的正极 C、电子由a电极经外电路向b电极移动,再经电解质溶液回到a电极 D、b极电极反应式为:O2+ 2H2O + 4e-=4OH-16. 下列说法正确的是( )A、氯化钠晶体熔融时需要克服离子键 B、石英和干冰都属于原子晶体 C、CH4、CO2中所有原子均满足最外层8 电子稳定结构 D、KOH和 CaCl2 都是含有共价键的离子化合物17. 反应CO(g)+ 2H2(g)=CH3OH(g) 的能量变化如图所示,下列说法正确的是( ) A、由图可知,1mol CH3OH(g)的能量低于2mol H2 (g) 的能量 B、断开1 molH2(g)中的化学键需要吸收209.5 kJ 的能量 C、CO(g)+ 2H2(g) = CH3OH ( l) ΔH= -91 kJ•mol-1 D、CH3OH (g)= CO(g)+ 2 H2 (g) ΔH = 91 kJ•mol-118. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,32g O2和O3的混合气体中含有的氧原子数为2NA B、1mol OH-中含有的电子数为8NA C、4.6 gNa与足量O2完全反应,转移的电子数为0.4NA D、标准状况下,2.24L水中含有O—H键的数目为0.2NA19. 已知:2N2O5 (g)⇌4NO2 (g)+ O2(g) ΔH =QkJ•mol-1 (Q >0), 一定温度下,向 2 L 的恒容密闭容器中通入N2O5 , 实验测得的部分数据如表:
A、由图可知,1mol CH3OH(g)的能量低于2mol H2 (g) 的能量 B、断开1 molH2(g)中的化学键需要吸收209.5 kJ 的能量 C、CO(g)+ 2H2(g) = CH3OH ( l) ΔH= -91 kJ•mol-1 D、CH3OH (g)= CO(g)+ 2 H2 (g) ΔH = 91 kJ•mol-118. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,32g O2和O3的混合气体中含有的氧原子数为2NA B、1mol OH-中含有的电子数为8NA C、4.6 gNa与足量O2完全反应,转移的电子数为0.4NA D、标准状况下,2.24L水中含有O—H键的数目为0.2NA19. 已知:2N2O5 (g)⇌4NO2 (g)+ O2(g) ΔH =QkJ•mol-1 (Q >0), 一定温度下,向 2 L 的恒容密闭容器中通入N2O5 , 实验测得的部分数据如表:时间/s
0
500
l000
1500
n(N2O5)/mol
10.0
7.0
5.0
5.0
下列说法正确的是( )
A、0~1000s内,用N2O5表示的平均反应速率为0.005mol·L-1•s‑1 B、从表中数据可知,在 1000s 时,反应恰好达到平衡状态 C、反应达到平衡时,容器内压强保持不变 D、充分反应后,吸收的热量为 5QkJ20. 下列实验方案能达到实验目的的是( )选项
实验目的
实验方案
A
比较Cl 和Si 非金属性强弱
向硅酸钠溶液中滴加盐酸,观察实验现象
B
配制100mL1.0 mol•L-1 NaOH溶液
称取NaOH固体4.0 g放入100mL容量瓶中,加水溶解,然后桸释至液面与刻度线相切
C
测定0.01 mol•L-1 NaClO溶液的pH
用洁净的玻璃棒蘸取待测液点到湿润的 pH试纸上,变色后与标准比色卡对照
D
验证氢氧化钡与氯化铵反应为吸热反应
在烧杯中加入一定量的氢氧化钡和氯化铵晶体,用玻璃棒搅拌,使之充分混合,用手触摸烧杯外壁
A、A B、B C、C D、D21. 几种含硫物质的转化如图所示(部分产物可能略去)。下列说法错误的是( )SO2 Na2SO3 溶液 Na2SO4溶液
A、X可以是Na2CO3溶液 B、Y一定是O2 C、反应①的离子方程式可能为:SO2+2OH- =SO + H2O D、SO2、Na2SO3都能使酸性高锰酸钾溶液褪色22. 中科院科研人员在 Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。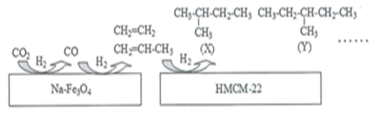
下列说法错误的是( )
A、Na-Fe3O4和HMCM-22在反应中作催化剂 B、利用 CO2 合成烷烃有利于减少对化石能源的依赖并减少碳排放 C、转化过程的原子利用率为 100% D、X 与 Y 都有 4 种一氯代物23. 聚合硫酸铁[ Fe(OH)SO4]n易溶于水,能用作净水剂(絮凝剂),可由绿矾(FeSO4•7H2O)和KClO3在水溶液中反应得到。下列说法错误的是( )A、KClO3在反应中作氧化剂 B、每生成 1 mol [ Fe(OH)SO4]n 转移1mol电子 C、将绿矾水溶液久置于空气中,滴加几滴 KSCN 溶液,溶液变血红色 D、聚合硫酸铁可在水中形成氢氧化铁胶体,故能用作净水剂24. 向200mL Na2CO3和 NaHCO3混合溶液中缓慢滴加0.1 mol•L-1稀盐酸,当加入的盐酸体积为100 mL后开始产生气体,加到 amL 时测得产生的气体在标准状况下体积为0.672L,继续滴加盐酸不再产生气体(不考虑气体的溶解)。下列说法错误的是( )A、a=400 B、原溶液中c(NaHCO3)=0.1 mol•L-1 C、滴加稀盐酸50mL时,溶液中n(Na2CO3):n(NaHCO3)=1:2 D、产生气体时反应的离子方程式为:H++ HCO =CO2↑+ H2O25. 现有一份由含有Na2CO3、Fe2(SO4)3、K2SO4、MgCl2、CaCO3、NH4Cl中的某几种物质组成的固体混合物X。某化学课外小组取样品进行了如图实验:
下列说法正确的是( )
A、固体X中一定存在Fe2(SO4)3 或K2SO4 B、固体X 中至少存在三种物质 C、白色沉淀一定是CaCO3和 BaSO4的混合物 D、固体X中一定含有NH4Cl、CaCO3 , 可能含有MgCl2、Na2CO326. 用 O2氧化一定浓度的 FeCl2 溶液,所测的三组实验数据如图所示。下列说法错误的是( ) A、其他条件相同时,温度越高, Fe2+ 氧化率越大 B、其他条件相同时,pH越小,Fe2+氧化率越大 C、6h 内,①条件下Fe2+被氧化的速率最大 D、③条件下,0~ 2h 与 2~ 4h,Fe2+被氧化的速率相等27. 室温下,下列实验事实中不能说明氨水是弱电解质溶液的是( )A、0.10 mol•L-1氨水pH=11 B、0.10mo l• L-1(NH4)2SO4溶液 pH< 7 C、等体积等浓度的氨水和盐酸恰好能完全反应 D、等浓度的氨水、氢氧化钠溶液,氨水导电能力弱的多28. 下列说法正确的是( )A、某温度下,某溶液的pH=6,则该溶液一定显酸性 B、常温下,同浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大于醋酸 C、等浓度的醋酸钠和醋酸混合溶液显酸性,则溶液中c(Na+)>c(CH3COO- ) D、醋酸钠溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)29. 向200mL Na2CO3和 NaHCO3混合溶液中缓慢滴加0.1 mol•L-1稀盐酸,当加入的盐酸体积为100 mL后开始产生气体,加到 amL 时测得产生的气体在标准状况下体积为0.672L,继续滴加盐酸不再产生气体(不考虑气体的溶解)。下列说法错误的是( )A、a=400 B、原溶液中c(NaHCO3)=0.1 mol•L-1 C、滴加稀盐酸50mL时,溶液中n(Na2CO3):n(NaHCO3)=1:2 D、产生气体时反应的离子方程式为:H++ HCO =CO2↑+ H2O30. 现有一份由含有Na2CO3、Fe2(SO4)3、K2SO4、MgCl2、CaCO3、NH4Cl中的某几种物质组成的固体混合物X。某化学课外小组取样品进行了如图实验:
A、其他条件相同时,温度越高, Fe2+ 氧化率越大 B、其他条件相同时,pH越小,Fe2+氧化率越大 C、6h 内,①条件下Fe2+被氧化的速率最大 D、③条件下,0~ 2h 与 2~ 4h,Fe2+被氧化的速率相等27. 室温下,下列实验事实中不能说明氨水是弱电解质溶液的是( )A、0.10 mol•L-1氨水pH=11 B、0.10mo l• L-1(NH4)2SO4溶液 pH< 7 C、等体积等浓度的氨水和盐酸恰好能完全反应 D、等浓度的氨水、氢氧化钠溶液,氨水导电能力弱的多28. 下列说法正确的是( )A、某温度下,某溶液的pH=6,则该溶液一定显酸性 B、常温下,同浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大于醋酸 C、等浓度的醋酸钠和醋酸混合溶液显酸性,则溶液中c(Na+)>c(CH3COO- ) D、醋酸钠溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)29. 向200mL Na2CO3和 NaHCO3混合溶液中缓慢滴加0.1 mol•L-1稀盐酸,当加入的盐酸体积为100 mL后开始产生气体,加到 amL 时测得产生的气体在标准状况下体积为0.672L,继续滴加盐酸不再产生气体(不考虑气体的溶解)。下列说法错误的是( )A、a=400 B、原溶液中c(NaHCO3)=0.1 mol•L-1 C、滴加稀盐酸50mL时,溶液中n(Na2CO3):n(NaHCO3)=1:2 D、产生气体时反应的离子方程式为:H++ HCO =CO2↑+ H2O30. 现有一份由含有Na2CO3、Fe2(SO4)3、K2SO4、MgCl2、CaCO3、NH4Cl中的某几种物质组成的固体混合物X。某化学课外小组取样品进行了如图实验:
下列说法正确的是( )
A、固体X中一定存在Fe2(SO4)3 或K2SO4 B、固体X 中至少存在三种物质 C、白色沉淀一定是CaCO3和 BaSO4的混合物 D、固体X中一定含有NH4Cl、CaCO3 , 可能含有MgCl2、Na2CO3二、填空题
-
31.(1)、①写出漂白粉主要成分的化学式::②写出氧化钠的电子式:。(2)、写出碳与浓硫酸反应的化学方程式: 。
三、推断题
-
32. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素 ,元素X 与其它四种元素不在同一周期,但X 与Z 元素在同一主族;W单质常用来制造信号弹和焰火,且W 原子核外电子总数是Y 的2倍,R 元素在同周期中原子半径最小.回答下列问题:(1)、X的元素符号为 , Y 元素在周期表中位置是。(2)、YR4的结构式为 。(3)、R单质与Z的最高价氧化物对应水化物反应的离子方程式为。(4)、金属性强弱:WZ ( 填“> ”或“< ”), 请设计一个简单的实验方案加以验证:。33. 常见有机物 A、B、C、D、E的相互转化关系如图。已知E是有香味且不溶于水的油状液体,A 是石油裂解气的主要成分,且气体A在标准状况下的密度为1.25 g•L-1。

请回答:
(1)、C中含有的官能团名称是 , E的结构简式为 。(2)、A→B的化学方程式为 , A+ D →E的反应类型是。(3)、淀粉水解可得到F,F在酒化酶的作用下可生成B,写出F的化学式。(4)、下列说法正确的是。a.直接用分液的方法可以除去E中混有的D
b.B和D在一定条件下也可以反应生成E
c.等物质的量的A 和B 完全燃烧消耗的氧气量相等
d.A 能使酸性KMnO4溶液、溴水褪色,其褪色原理相同
34. 为了探究某不带结晶水的固X体(含四种元素,200g•mol -1<M<300g•mol-1 )的组成,设计并完成了如图实验:
请回答:
(1)、固体X中含有的元素是H、O、 , 水的质量为g。(2)、蓝色溶液中加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子反应方程式。(3)、X的化学式是。四、实验题
-
35. 某学习小组为探究甲烷与氯气的反应,设计了如图装置

回答下列问题:
(1)、装置B中发生反应的化学方程式为。(2)、装置C的作用是。(3)、装置E中经过高压汞灯的强光照射后,生成的含氯有机物最多有种,且E中实验现象有。(4)、F中球形干燥管的作用是。(5)、某同学取反应后F中的溶液,加入足量硝酸酸化的硝酸银溶液,产生白色沉淀,就证明甲烷与氯气发生了取代反应,你认为是否合理 , 请说明理由。五、计算题
-
36. 现有一份MgSO4和(NH4)2SO4的混合溶液,向该溶液中加入一定浓度的Ba(OH)2溶液,产生的沉淀质量(m)与加入Ba(OH) 2溶液的体积(V)关系如图。
 (1)、Ba(OH)2溶液的物质的量浓度为mol•L-1。(2)、该混合溶液MgSO4和(NH 4)2SO4物质的量之比为。
(1)、Ba(OH)2溶液的物质的量浓度为mol•L-1。(2)、该混合溶液MgSO4和(NH 4)2SO4物质的量之比为。
-
-