广西钦州市2019-2020学年高一下学期化学期末考试试卷(理)
试卷更新日期:2020-09-17 类型:期末考试
一、单选题
-
1. 下列有关化学用语表示正确的是( )A、Na2O2中的阴离子符号:O2- B、Na和Cl形成离子键的过程:
 C、次氯酸的结构式:H—Cl—O
D、比例模型
C、次氯酸的结构式:H—Cl—O
D、比例模型  可表示CH4分子,也可表示CCl4分子
2. 化学与生活、社会发展息息相关。下列叙述正确的是( )A、稀的食盐水能杀死COVID-19病毒 B、石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 C、外形似海绵、密度小、有磁性的碳与石墨不再互为同素异形体 D、“世间丝、麻、裘皆具素质....”,这里丝、麻的主要成分是蛋白质3. 下列有关性质的比较,不能用元素周期律解释的是( )A、原子半径:C>O B、金属性:Na>Al C、热稳定性:H2O>H2S D、酸性:HCl>H2SiO34. 从金属利用的历史来看,先是青铜器时代而后是铁器时代,铝的利用是近百年的事.这个先后顺序跟下列有关的是( )
可表示CH4分子,也可表示CCl4分子
2. 化学与生活、社会发展息息相关。下列叙述正确的是( )A、稀的食盐水能杀死COVID-19病毒 B、石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 C、外形似海绵、密度小、有磁性的碳与石墨不再互为同素异形体 D、“世间丝、麻、裘皆具素质....”,这里丝、麻的主要成分是蛋白质3. 下列有关性质的比较,不能用元素周期律解释的是( )A、原子半径:C>O B、金属性:Na>Al C、热稳定性:H2O>H2S D、酸性:HCl>H2SiO34. 从金属利用的历史来看,先是青铜器时代而后是铁器时代,铝的利用是近百年的事.这个先后顺序跟下列有关的是( )①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性.
A、①③ B、②⑤ C、③⑤ D、②④5. 下列各组化合物中,化学键的类型完全相同的是( )①CaCl2和Na2S ②Na2O和Na2O2 ③CO2和CS2 ④HCl和NaOH
A、①② B、①③ C、②③ D、②④6. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法错误的是( ) A、原子半径大小:X > Y > Z B、W、Y两种元素都能与氧元素形成化合物WO2、YO2 C、氧化物对应水化物的酸性: Z > Y > W D、Y能形成H2Y、H2YO4的化合物7. 下列物质中,能使酸性KMnO4溶液褪色的物质是( )
A、原子半径大小:X > Y > Z B、W、Y两种元素都能与氧元素形成化合物WO2、YO2 C、氧化物对应水化物的酸性: Z > Y > W D、Y能形成H2Y、H2YO4的化合物7. 下列物质中,能使酸性KMnO4溶液褪色的物质是( )①
 ②乙烯③CH3COOH④CH3CH2OH⑤
②乙烯③CH3COOH④CH3CH2OH⑤  A、①⑤ B、②④ C、①③ D、②⑤8. 下列说法错误的是( )A、1mol乙烷在光照条件下最多能与3molCl2发生取代反应 B、石油裂解气能使溴的四氯化碳溶液,酸性KMnO4溶液褪色 C、水煤气可用来合成液态烃及甲醇等含氧有机物 D、苯可通过取代反应制得硝基苯、氯苯9. 反应N2+3H2 2NH3刚开始时,N2的浓度为3mol·L-1 ,H2的浓度为5mol·L-1 , 3min后测得NH3的浓度为0.6mol·L-1则此时间内,下列反应速率表示正确的是( )A、v (NH3)= 0.1 mol˙L-1˙min-1 B、v (N2) = 1.0 mol˙L-1˙min-1 C、v (H2) = 1.67 mol˙L-1˙min-1 D、v (H2) = 0.3 mol˙L-1˙min-110. 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g) Y(g)+Z(g),达到反应限度的标志是( )A、反应容器中压强不再变化 B、反应容器中密度不再变化 C、X、Y、Z的浓度之比为2:1:1 D、单位时间内生成1molY的同时生成2molX11. 石墨在一定条件下转化为金刚石,其能量变化如图所示,其中△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
A、①⑤ B、②④ C、①③ D、②⑤8. 下列说法错误的是( )A、1mol乙烷在光照条件下最多能与3molCl2发生取代反应 B、石油裂解气能使溴的四氯化碳溶液,酸性KMnO4溶液褪色 C、水煤气可用来合成液态烃及甲醇等含氧有机物 D、苯可通过取代反应制得硝基苯、氯苯9. 反应N2+3H2 2NH3刚开始时,N2的浓度为3mol·L-1 ,H2的浓度为5mol·L-1 , 3min后测得NH3的浓度为0.6mol·L-1则此时间内,下列反应速率表示正确的是( )A、v (NH3)= 0.1 mol˙L-1˙min-1 B、v (N2) = 1.0 mol˙L-1˙min-1 C、v (H2) = 1.67 mol˙L-1˙min-1 D、v (H2) = 0.3 mol˙L-1˙min-110. 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g) Y(g)+Z(g),达到反应限度的标志是( )A、反应容器中压强不再变化 B、反应容器中密度不再变化 C、X、Y、Z的浓度之比为2:1:1 D、单位时间内生成1molY的同时生成2molX11. 石墨在一定条件下转化为金刚石,其能量变化如图所示,其中△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( ) A、金刚石的稳定性强于石墨的 B、石墨转化为金刚石属于物理变化 C、1 mol金刚石的能量大于1 mol CO2的能量 D、1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量12. 某干电池的工作原理如图所示,总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
A、金刚石的稳定性强于石墨的 B、石墨转化为金刚石属于物理变化 C、1 mol金刚石的能量大于1 mol CO2的能量 D、1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量12. 某干电池的工作原理如图所示,总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )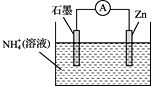 A、石墨为电池的负极 B、电池工作时NH4+被氧化 C、实现了电能向化学能转化 D、电子由Zn电极经外电路流向石墨电极13. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
A、石墨为电池的负极 B、电池工作时NH4+被氧化 C、实现了电能向化学能转化 D、电子由Zn电极经外电路流向石墨电极13. 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( ) A、杠杆为导体或绝缘体时,均为A端高B端低 B、杠杆为导体或绝缘体时,均为A端低B端高 C、当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高 D、当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低14. 少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
A、杠杆为导体或绝缘体时,均为A端高B端低 B、杠杆为导体或绝缘体时,均为A端低B端高 C、当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高 D、当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低14. 少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O
②加NaOH固体
③滴入几滴浓盐酸
④将稀盐酸换为98%的硫酸
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用10mL0.1mol/L盐酸
A、①⑥⑦ B、③⑤⑧ C、③⑦⑧ D、⑥⑦⑧15. 下列实验能获得成功的是( )A、苯和浓溴水用铁做催化剂制溴苯 B、用酸性高锰酸钾溶液除去甲烷中混有的乙烯 C、甲烷与氯气光照制得纯净的一氯甲烷 D、乙烯通入溴的四氯化碳溶液得到1,2—二溴乙烷16. 在①丙烯(CH3—CH=CH2)、②氯乙烯、③苯、④乙醇四种有机化合物中,分子内所有原子均在同一平面的是( )A、①② B、②③ C、③④ D、②④17. 根据元素周期表和元素周期律,判断下列叙述错误的是( )A、气态氢化物的稳定性:H2O>NH3>SiH4 B、氢元素与其他元素可形成共价化合物或离子化合物 C、如图所示实验可证明元素的非金属性:Cl>C>Si D、用中文“
D、用中文“  ”(ào)命名的第118号元素在周期表中位于第七周期0族
18. 工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。假设以下反应都能进行,从经济效益方面考虑最合理的反应是( )A、 B、 C、 D、19. 工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
”(ào)命名的第118号元素在周期表中位于第七周期0族
18. 工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。假设以下反应都能进行,从经济效益方面考虑最合理的反应是( )A、 B、 C、 D、19. 工业上用铝土矿(主要成分为Al2O3 , 含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )
A、按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸 B、反应①过滤后所得沉淀为氧化铁 C、图中所有的转化反应都不是氧化还原反应 D、反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-20. 实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
光照下反应一段时间后,下列装置示意图中能符合题意反映实验现象的是( )
A、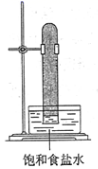 B、
B、 C、
C、 D、
D、
二、填空题
-
21. 现有8种短周期元素的性质,数据如下表所列:
①
②
③
④
⑤
⑥
⑦
⑧
原子半径(10-10m)
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最低化合价
+2
+1
+5
+7
+1
+5
+3
-2
-3
-1
-3
回答下列问题:
(1)、③的元素符号是 , ⑧的元素名称是。①在元素周期表中的位置是 (周期、族)。(2)、在这8种元素中,最高价氧化物对应的水化物中,酸性最强的化合物其分子式是;碱性最强的化合物电子式是;属化合物(填“离子”或“共价”)。(3)、比较④和⑦的氢化物的稳定性 (用化学式表示)。(4)、写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:。(5)、写出②的最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:。22. A~E等几种烃分子的球棍模型如图所示,据此回答下列问题. (1)、D的分子式为 , A的二氯取代物有种,属于同系物的是(填字母)。(2)、有关有机物E的结构或性质的说法正确的是(填字母)。
(1)、D的分子式为 , A的二氯取代物有种,属于同系物的是(填字母)。(2)、有关有机物E的结构或性质的说法正确的是(填字母)。a.是碳碳双键和碳碳单键交替的结构
b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液和溴的四氯化碳褪色
d.一定条件下能与氢气或氧气反应
(3)、已知有机物C能与HCN反应,原理与其和H2O反应类似,请写出相关的化学反应方程式: , 反应类型。23. 从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:(1)、A的分子式 , B的结构简式 。(2)、A能使溴的四氯化碳溶液褪色,其化学反应方程式为 。(3)、在碘水中加入B振荡静置后的现象 。(4)、B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: , 反应类型 。(5)、A的同系物分子式为C3H6的烃是制作N95口罩熔喷布的材料,写出它发生加聚反应的化学方程式。三、解答题
-
24. 如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。
 (1)、若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为 , 当有1.6g负极材料溶解时,转移的电子为mol;(2)、若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为→ (填电极材料,下同),溶液中的NO 向极移动;(3)、氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为。
(1)、若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为 , 当有1.6g负极材料溶解时,转移的电子为mol;(2)、若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为→ (填电极材料,下同),溶液中的NO 向极移动;(3)、氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为。四、实验题
-
25. 海带中含有丰富的碘。为了从海中提取碘,某研究性学习小姐设计并进行了以下实验,请填写下列空白:
 (1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___(用标号字母填写在空白处)。A、烧杯 B、坩埚 C、表面皿 D、泥三角 E、酒精灯 F、干燥器(2)、步骤③的实验操作名称是 , 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。(3)、步骤④反应的离子方程式是。(4)、步骤⑤中,某学生选择用苯来提取碘的理由是、。(5)、请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:。
(1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___(用标号字母填写在空白处)。A、烧杯 B、坩埚 C、表面皿 D、泥三角 E、酒精灯 F、干燥器(2)、步骤③的实验操作名称是 , 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。(3)、步骤④反应的离子方程式是。(4)、步骤⑤中,某学生选择用苯来提取碘的理由是、。(5)、请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:。五、计算题
-
26. 把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算(1)、前2min内用W的浓度变化表示的平均反应速率为。(2)、2min末时Y的浓度为。(3)、化学反应方程式中n=。(4)、2min末,恢复到反应前温度,体系内压强是反应前压强的倍。
-
-