浙江省台州市2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2020-09-14 类型:期末考试
一、单选题
-
1. 下列物质属于离子化合物的是( )A、 B、 C、 D、2. 蒸馏时须用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质属于非电解质的是( )A、 B、 C、 D、4. 化学与生产生活密切相关,下列说法错误的是( )A、可用CaCO3、MgCO3和Al(OH)3等做抗酸药 B、CaO可用作干燥剂和抗氧化剂 C、FeSO4∙7H2O是生产铁系净水剂的原料 D、分子筛常用于分离、提纯气体或液体混合物5. 下列化学用语使用正确的是( )A、 分子的结构式: B、水分子的球棍模型:
3. 下列物质属于非电解质的是( )A、 B、 C、 D、4. 化学与生产生活密切相关,下列说法错误的是( )A、可用CaCO3、MgCO3和Al(OH)3等做抗酸药 B、CaO可用作干燥剂和抗氧化剂 C、FeSO4∙7H2O是生产铁系净水剂的原料 D、分子筛常用于分离、提纯气体或液体混合物5. 下列化学用语使用正确的是( )A、 分子的结构式: B、水分子的球棍模型: C、 的结构示意图:
C、 的结构示意图:  D、硫化钠的电子式:
D、硫化钠的电子式:  6. 下列物质间的转化一定需要加入氧化剂才能实现的是( )A、C→CO2 B、H2O2→O2 C、Na2SO3→SO2 D、KMnO4→MnO27. 下列物质的转化在给定条件下能实现的是( )A、 B、 C、 D、8. 下列试剂保存方法错误的是( )A、氢氟酸盛装在塑料瓶中 B、液溴易挥发,在存放液溴的试剂瓶中应加水液封 C、保存FeCl3溶液时,通常在溶液中加少量的单质铁 D、浓硝酸保存在棕色试剂瓶中,并置于冷暗处9. 粗盐提纯的过程中,涉及的实验操作正确的是( )A、粗盐溶解
6. 下列物质间的转化一定需要加入氧化剂才能实现的是( )A、C→CO2 B、H2O2→O2 C、Na2SO3→SO2 D、KMnO4→MnO27. 下列物质的转化在给定条件下能实现的是( )A、 B、 C、 D、8. 下列试剂保存方法错误的是( )A、氢氟酸盛装在塑料瓶中 B、液溴易挥发,在存放液溴的试剂瓶中应加水液封 C、保存FeCl3溶液时,通常在溶液中加少量的单质铁 D、浓硝酸保存在棕色试剂瓶中,并置于冷暗处9. 粗盐提纯的过程中,涉及的实验操作正确的是( )A、粗盐溶解 B、分离泥沙
B、分离泥沙  C、滴加试剂除
C、滴加试剂除  D、蒸发结晶
D、蒸发结晶  10. 下列说法错误的是( )A、将氯气通入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 B、广范pH试纸测得某酸性溶液的pH为5.5 C、用澄清石灰水鉴别CO和CO2 D、金属钠着火时,可用细沙覆盖灭火11. 下列实验装置或操作与实验目的相符的是( )
10. 下列说法错误的是( )A、将氯气通入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 B、广范pH试纸测得某酸性溶液的pH为5.5 C、用澄清石灰水鉴别CO和CO2 D、金属钠着火时,可用细沙覆盖灭火11. 下列实验装置或操作与实验目的相符的是( )



A.证明 氧化性强于
B.制取少量的
C.检验溶液中是否含有
D.除去 中的少量
A、A B、B C、C D、D12. 下列说法正确的是( )A、溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶粒越大 B、用电子天平称量NaOH固体时,需要先称小烧杯的质量 C、KMnO4固体结块后,可将其在研钵中研磨成粉末再进行使用 D、牙膏中的甘油可用新制氢氧化铜悬浊液检验,现象是产生绛蓝色溶液13. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、足量的钠在 中充分燃烧,钠失去的电子数为 B、密闭容器中, 和 催化反应后分子总数为 C、 晶体中阴离子和阳离子总数为 D、常温常压下, 中所含 键数目为14. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、加入铝粉能放出氢气的溶液中:Na+、Mg2+、Cl-、 B、由水电离出的c(OH-)=1.0×10-13mol/L的溶液中: 、I-、Ca2+、 C、0.1mol/LNH4HCO3溶液中:K+、Na+、 、Br- D、使甲基橙变红的溶液中: 、K+、Fe2+、15. 能正确表示下列反应的离子方程式是( )A、浓盐酸与软锰矿混合后加热产生黄绿色气体: B、硫酸酸化的淀粉碘化钾溶液在空气中变蓝: C、向摩尔盐中加入足量的 溶液: D、用氨水溶解 沉淀:16. 从含有KI、KNO3等成分的废水中回收I2和KNO3 , 其流程如图所示,下列说法错误的是( )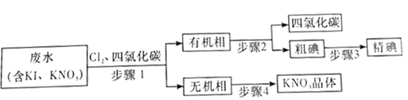 A、步骤1中有机相应从分液漏斗的下口放出,无机相从上口倒出 B、步骤2可采用减压蒸馏的方法分离四氯化碳和碘 C、步骤3可利用碘易升华的性质提纯粗碘 D、步骤4将溶液蒸发至大量晶体析出时,再用余热蒸干17. 已知下表中几种物质的熔、沸点:
A、步骤1中有机相应从分液漏斗的下口放出,无机相从上口倒出 B、步骤2可采用减压蒸馏的方法分离四氯化碳和碘 C、步骤3可利用碘易升华的性质提纯粗碘 D、步骤4将溶液蒸发至大量晶体析出时,再用余热蒸干17. 已知下表中几种物质的熔、沸点:熔点/℃
801
730
190
1040
沸点/℃
1413
1380
180
1537
据此判断,下列说法错误的是( )
A、 和 熔融时通电,会发生化学变化 B、 晶体中存在分子间作用力 C、 晶体中的化学键是离子键 D、 晶体为离子晶体18. 某兴趣小组用如图所示的装置探究SO2气体的还原性,下列说法错误的是( ) A、①中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++ +4H+ B、①中加入KMnO4溶液,紫红色褪去,可说明SO2与FeCl3发生了氧化还原反应 C、②中蓝色溶液褪色的现象能表明I-的还原性弱于SO2 D、装置③的作用是吸收SO2尾气,防止污染空气19. 一种广泛用于锂离子电池的物质,其结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是( )
A、①中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++ +4H+ B、①中加入KMnO4溶液,紫红色褪去,可说明SO2与FeCl3发生了氧化还原反应 C、②中蓝色溶液褪色的现象能表明I-的还原性弱于SO2 D、装置③的作用是吸收SO2尾气,防止污染空气19. 一种广泛用于锂离子电池的物质,其结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是( ) A、非金属性 B、X分别与Y和W形成的三原子化合物均可作为灭火剂 C、X的氢化物可与Z的单质发生反应 D、Y在该化合物中有两种不同价态20. 某学生进行了如下实验:
A、非金属性 B、X分别与Y和W形成的三原子化合物均可作为灭火剂 C、X的氢化物可与Z的单质发生反应 D、Y在该化合物中有两种不同价态20. 某学生进行了如下实验:编号
Ⅰ
Ⅱ
实验


现象
a中产生凝胶状沉淀
b中凝胶状沉淀溶解,c中无明显变化
下列结论正确的是( )
A、由Ⅰ能说明酸性 B、由Ⅱ可知结合氢离子的能力 C、向Na2SiO3溶液中通入少量CO2 , 发生反应 D、将新制的硅酸与硅酸钠溶液混合不会出现明显现象21. 高铜酸钾化学式KCuO2 , 为黑色粉末状固体,在酸性和中性条件下不稳定。下列说法错误的是( )A、KCuO2的水溶液呈碱性 B、可将KCuO2改写成K2O2∙2CuO或K2O∙Cu2O3的形式 C、KCuO2具有强氧化性 D、已知KCuO2高温时会分解生成K2CuO2、CuO和一种气体,该气体为O222. 已知Pb3O4与HNO3溶液发生反应Ⅰ:Pb3O4+4H+=PbO2+2Pb2++2H2O;PbO与酸化的MnSO4溶液发生反应Ⅱ:5PbO2+2Mn2++4H++5 =2 +5PbSO4+2H2O。下列推断错误的是( )A、由反应Ⅰ可知,Pb3O4中Pb(Ⅱ)和Pb(Ⅳ)含量之比为2∶1 B、由反应Ⅱ可知,氧化性:PbO2> C、Pb可与稀硝酸发生反应:3Pb+16HNO3=3Pb(NO3)4+4NO↑+8H2O D、Pb3O4可与盐酸发生反应:Pb3O4+8HCl=3PbCl2+4H2O+Cl2↑23. 将I2加入NaOH稀溶液后所得的溶液中,主要含有Na+、I-、 、OH-四种离子(除水分子外,其他微粒忽略不计),已知溶液中Na+和I-物质的量浓度分别为:0.3mol/L、0.1mol/L,则溶液中c(OH-)为( )A、0.3mol/L B、0.02mol/L C、0.18mol/L D、0.05mol/L24. 利用炼铝厂的废料——铝灰(含 、 及少量 和 )制备明矾的工艺流程如图所示,已知:上层溶液B呈紫红色,滤渣2中含有 ,下列说法正确的是( ) A、滤渣1的主要成分是 和 ,下层沉淀C为红褐色 B、滤液A中加入 溶液所发生反应的离子方程式: C、上层溶液B的酸性弱于滤液D的酸性 D、操作Ⅱ为蒸发结晶、趁热过滤、洗涤、干燥25. 某固体X可能含有FeO、Fe2O3、MnO2、NaAlO2、K2SO3、Na2CO3、NaClO、K2SO4中的几种物质,进行如下实验以确定其组成,下列有关说法错误的是( )
A、滤渣1的主要成分是 和 ,下层沉淀C为红褐色 B、滤液A中加入 溶液所发生反应的离子方程式: C、上层溶液B的酸性弱于滤液D的酸性 D、操作Ⅱ为蒸发结晶、趁热过滤、洗涤、干燥25. 某固体X可能含有FeO、Fe2O3、MnO2、NaAlO2、K2SO3、Na2CO3、NaClO、K2SO4中的几种物质,进行如下实验以确定其组成,下列有关说法错误的是( ) A、若固体X中不含K2SO4 , 则一定含NaClO B、固体X中可能不含有Fe2O3 C、溶液E中一定含有K+和 D、气体D可能是纯净物(忽略水蒸气)
A、若固体X中不含K2SO4 , 则一定含NaClO B、固体X中可能不含有Fe2O3 C、溶液E中一定含有K+和 D、气体D可能是纯净物(忽略水蒸气)二、填空题
-
26.(1)、常作食盐中补碘剂的含氧酸盐的化学名称。(2)、“芒硝”可作为中药药材,主要治疗热积便秘、腹满胀痛、目赤、口疮等病症,其化学式为。(3)、写出炼铁高炉中生成炉渣的化学方程式。(4)、镁与氧化硼( )可发生类似“铝热反应”的反应,写出该反应的化学方程式。(5)、 可作为 水溶液中硫元素发生自身氧化还原反应的催化剂,其催化经历了ⅰ和ⅱ两个过程。ⅰ的离子方程式为。
ⅰ.……=……
ⅱ.
三、实验题
-
27. 亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置及尾气吸收装置已省略)和药品探究亚硝酸钠与硫酸反应的气体产物。
已知:气体的沸点 : ℃, :21℃
 (1)、写出装置A中发生反应的化学方程式。(2)、B装置中选择的水浴方式为(填“冰水浴”或“热水浴”)。(3)、反应前应先打开弹簧夹,先通一段时间 ,其目的是。(4)、能够说明气体产物中有 的实验现象是。28. 将ClO2通入NaOH和H2O2的混合溶液中,可制得一种高效漂白剂亚氯酸钠(NaClO2),实验装置如图所示:
(1)、写出装置A中发生反应的化学方程式。(2)、B装置中选择的水浴方式为(填“冰水浴”或“热水浴”)。(3)、反应前应先打开弹簧夹,先通一段时间 ,其目的是。(4)、能够说明气体产物中有 的实验现象是。28. 将ClO2通入NaOH和H2O2的混合溶液中,可制得一种高效漂白剂亚氯酸钠(NaClO2),实验装置如图所示:
请回答:
(1)、写出A装置中发生反应的离子方程式。(2)、请设计实验方案探究通入ClO2一段时间后,B装置溶液中存在的含有硫元素的微粒。29. 过氧化钙 是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。制备流程如图所示。
已知:① ② 等强碱是 分解的催化剂
请回答下列问题:
(1)、 与盐酸制备 溶液时,盐酸不能过量,盐酸未过量的现象。(2)、在过氧化钙制备流程图中加入氨水的作用(答出两点)。(3)、制备过程中煮沸的目的。(4)、需在冰水浴中进行反应的原因(答出两点)。(5)、抽滤用如下装置完成,请选择字母代号补全正确的操作顺序(洗涤操作只做一次):开抽气泵→a→→e→→f→→关抽气泵。

a.转移固液混合物 b.关闭活塞A c.打开活塞A d.微开活塞A e.确认抽干 f.加洗涤剂洗涤
(6)、洗涤 的最佳试剂___________。A、95%的乙醇水溶液 B、浓盐酸 C、 溶液 D、 溶液(7)、也可采用如图所示装置制备 。
①仪器X的主要作用除导气外,还具有的作用是。
②实验时,在三颈烧瓶中析出 晶体,总反应的离子方程式为。
四、计算题
-
30. 将mg的FexS(S为-2价,Fe有+2和+3价与100mL 6mol/L的盐酸反应,恰好得到FeCl2溶液,同时生成3.2g的硫单质和标准状况下V1L的硫化氢气体。(1)、V1=。(2)、FexS中Fe2+与Fe3+的物质的量之比。(3)、若将mg的FexS与足量的稀HNO3反应会生成单质硫和标准状况下V2L的NO气体,则V2=。
五、推断题
-
31. 固体化合物A由三种元素组成,按如下流程进行实验。

请回答:
(1)、组成A的三种元素是 , A的化学式是。(2)、固体A与足量稀盐酸反应的化学方程式是。(3)、在无水条件下,气体C与G以物质的量之比1∶1发生加成反应,其产物的结构简式。(4)、组成A的两种元素可形成离子化合物H(摩尔质量为 ),其电子式。
-
-