安徽省合肥市庐江县2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2020-09-14 类型:期末考试
一、单选题
-
1. 化学与生产生活息息相关,下列说法错误的是( )A、秸秆大量焚烧将产生雾霾 B、由地沟油炼制的生物柴油属于烃类物质 C、“山东疫苗案”涉及的疫苗,因未冷藏储运而失效,这与蛋白质变性有关 D、硅胶多孔,常用作食品干燥剂2. 下列有关化学用语表示正确的是( )A、氮气分子的电子式:
 B、Cl-的结构示意图:
B、Cl-的结构示意图:  C、质子数为53、中子数为78的碘原子:
D、 水解方程式: +H2O⇌H3O+ +
3. NA代表阿伏加德罗常数的值,下列叙述正确的是( )A、1molHNO3作为氧化剂得到的电子数一定为3NA B、0.4mol/LNa2SO4溶液中,所含的Na+和 总数为1.2NA C、12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2NA D、常温常压下,16gO3与O2的混合物中含有氧原子数为NA4. 下列各物质中,互为同系物的是( )A、丙三醇和乙二醇 B、甲苯和苯乙烯 C、正丁烷和2,2-二甲基丙烷 D、1,3-丁二烯和1-戊炔5. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、0.1 mol/LNa2CO3溶液:K+、 、Cl-、 B、使甲基橙变红色的溶液:K+、Na+、 、 C、0.1 mol/L FeSO4溶液中:H+、Al3+、Cl-、 D、 =0.1 mol/L的溶液中:Na+、 、CH3COO-、6. 下列实验能达到预期目的的是( )A、
C、质子数为53、中子数为78的碘原子:
D、 水解方程式: +H2O⇌H3O+ +
3. NA代表阿伏加德罗常数的值,下列叙述正确的是( )A、1molHNO3作为氧化剂得到的电子数一定为3NA B、0.4mol/LNa2SO4溶液中,所含的Na+和 总数为1.2NA C、12g NaHSO4在熔融状态下可以电离出的阳离子数目0.2NA D、常温常压下,16gO3与O2的混合物中含有氧原子数为NA4. 下列各物质中,互为同系物的是( )A、丙三醇和乙二醇 B、甲苯和苯乙烯 C、正丁烷和2,2-二甲基丙烷 D、1,3-丁二烯和1-戊炔5. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、0.1 mol/LNa2CO3溶液:K+、 、Cl-、 B、使甲基橙变红色的溶液:K+、Na+、 、 C、0.1 mol/L FeSO4溶液中:H+、Al3+、Cl-、 D、 =0.1 mol/L的溶液中:Na+、 、CH3COO-、6. 下列实验能达到预期目的的是( )A、 蒸发溴水获取溴单质
B、
蒸发溴水获取溴单质
B、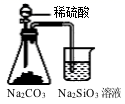 证明碳酸酸性强于硅酸
C、
证明碳酸酸性强于硅酸
C、 比较NaHCO3和Na2CO3的热稳定性
D、
比较NaHCO3和Na2CO3的热稳定性
D、 除去氯气中的HCl杂质
7. 已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构。则下列叙述正确的是( )A、原子半径:A>B>D>C B、原子序数:d>c>b>a C、原子的最外层电子数:C>D>A>B D、离子半径:C3->D->B+>A2+8. 下列有关物质性质与用途具有对应关系的是( )A、NH3具有还原性,可用作制冷剂 B、Si熔点高硬度大,可用于制半导体 C、Fe2(SO4)3具有氧化性,可用作净水剂 D、Al(OH)3具有弱碱性,可用于制胃酸中和剂9. 在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g) M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是( )A、0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1 B、当容器中混合气体密度不变时达到平衡状态 C、平衡后升高温度,X的反应速率降低 D、到达平衡状态时,反应放出的热量为a kJ10. 下列离子方程式书写正确的是( )A、向FeI2溶液通入少量氯气:2Fe2++ Cl2=2Fe3++ 2Cl- B、CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++ H2O+CO2↑ C、NaHCO3溶液中加入少量的澄清石灰水: + Ca2++OH-= CaCO3↓+ H2O D、向NH4Al(SO4)2溶液中加入氢氧化钡溶液,使 恰好沉淀完全: + Al3++2 +4OH- +2Ba2+=2BaSO4↓+ Al(OH)3↓+ NH3·H2O11. 下列物质的转化在给定条件下能实现的是( )A、NaCl(ag) NaHCO3(s) Na2CO3(s) B、Si SiO2 H2SiO3 C、CuCl2 Cu(OH)2 Cu2O D、MgO(s) Mg(NO3)2 (aq) Mg(s)12. 由溴乙烷制取乙二醇,依次发生反应的类型是( )A、取代、加成、水解 B、消去、加成、取代 C、水解、消去、加成 D、消去、水解、取代13. 某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
除去氯气中的HCl杂质
7. 已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构。则下列叙述正确的是( )A、原子半径:A>B>D>C B、原子序数:d>c>b>a C、原子的最外层电子数:C>D>A>B D、离子半径:C3->D->B+>A2+8. 下列有关物质性质与用途具有对应关系的是( )A、NH3具有还原性,可用作制冷剂 B、Si熔点高硬度大,可用于制半导体 C、Fe2(SO4)3具有氧化性,可用作净水剂 D、Al(OH)3具有弱碱性,可用于制胃酸中和剂9. 在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g) M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是( )A、0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1 B、当容器中混合气体密度不变时达到平衡状态 C、平衡后升高温度,X的反应速率降低 D、到达平衡状态时,反应放出的热量为a kJ10. 下列离子方程式书写正确的是( )A、向FeI2溶液通入少量氯气:2Fe2++ Cl2=2Fe3++ 2Cl- B、CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++ H2O+CO2↑ C、NaHCO3溶液中加入少量的澄清石灰水: + Ca2++OH-= CaCO3↓+ H2O D、向NH4Al(SO4)2溶液中加入氢氧化钡溶液,使 恰好沉淀完全: + Al3++2 +4OH- +2Ba2+=2BaSO4↓+ Al(OH)3↓+ NH3·H2O11. 下列物质的转化在给定条件下能实现的是( )A、NaCl(ag) NaHCO3(s) Na2CO3(s) B、Si SiO2 H2SiO3 C、CuCl2 Cu(OH)2 Cu2O D、MgO(s) Mg(NO3)2 (aq) Mg(s)12. 由溴乙烷制取乙二醇,依次发生反应的类型是( )A、取代、加成、水解 B、消去、加成、取代 C、水解、消去、加成 D、消去、水解、取代13. 某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) A、b极上的电极反应式为:O2+ 4H++4e-=2H2O B、电子通过外电路从b极流向a极 C、每转移0.1 mol电子,消耗1.12 L的H2 D、a极上发生还原反应14. 有一种有机化合物,其结构简式如图,下列有关它的性质的叙述,正确的是( )
A、b极上的电极反应式为:O2+ 4H++4e-=2H2O B、电子通过外电路从b极流向a极 C、每转移0.1 mol电子,消耗1.12 L的H2 D、a极上发生还原反应14. 有一种有机化合物,其结构简式如图,下列有关它的性质的叙述,正确的是( ) A、在一定条件下,1mol该物质最多能与6molNaOH完全反应 B、它能发生水解反应,水解后只能生成两种产物 C、在Ni催化下,1mol该物质可以和7molH2发生加成反应 D、有弱酸性,1mol该有机物与溴水反应,最多能消耗4molBr215. 25℃时,几种弱酸的电离常数如下,下列说法正确的是( )
A、在一定条件下,1mol该物质最多能与6molNaOH完全反应 B、它能发生水解反应,水解后只能生成两种产物 C、在Ni催化下,1mol该物质可以和7molH2发生加成反应 D、有弱酸性,1mol该有机物与溴水反应,最多能消耗4molBr215. 25℃时,几种弱酸的电离常数如下,下列说法正确的是( )弱酸
CH3COOH
H2SO3
H2CO3
电离常数(25℃)
1. 8×10-5
K1=1.5×10-2
K2=1.0×10-7
K1=4.3×10-7
K2=5.6×10-11
A、物质的量浓度相同的CH3COONa、NaHSO3、NaHCO3三种溶液中,pH顺序为NaHCO3>CH3COONa>NaHSO3 B、将NaHCO3溶液与NaHSO3溶液混合可以发生化学反应 C、常温下,加水稀释醋酸, 增大 D、Na2CO3溶液中一定存在c(Na+)=2[c( )]+c( )]16. 室温下,向10mL 0.1mol/L NaOH溶液中加入0.1mol/L一元酸HA溶液后pH的变化如图所示。下列说法正确的是( ) A、a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B、a、b两点所示溶液中水的电离程度相同 C、b点所示溶液中c(A-)>c(HA) D、pH=7时,c(Na+)=c(A-)+c(HA)
A、a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B、a、b两点所示溶液中水的电离程度相同 C、b点所示溶液中c(A-)>c(HA) D、pH=7时,c(Na+)=c(A-)+c(HA)二、实验题
-
17. 某研究性学习小组设计了如图装置制取和验证SO2的性质。

请回答:
(1)、写出图中仪器的名称:a , b 。(2)、棉球中NaOH溶液的作用是。(3)、为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_________A、紫色石蕊试液 B、无色酚酞试液 C、澄清石灰水 D、碘水(4)、下列说法正确的是_______A、为了美观,商家能用SO2漂白食品 B、先向装置中加入试剂(药品),再进行气密性检查 C、实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性 D、实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性(5)、写出铜与浓硫酸反应的化学方程式。三、工业流程
-
18. 铬是一种银白色金属,化学性质稳定,在化合物中常见价态为+2、+3和+6价等。工业上以铬铁矿(主要成分为FeO·Cr2O3 , 含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂) ,其主要工艺流程如图所示:

查阅资料得知:常温下,NaBiO3不溶于水有强氧化性,在碱性条件下能将Cr3+转化为 。回答下列问题:
(1)、工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式:。(2)、酸化滤液D时,不选用盐酸的原因是 。(3)、固体E的主要成分是Na2SO4 , 根据工艺流程图分析操作a为、、洗涤、干燥。 (4)、已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的 。
(4)、已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的 。
①Cr(OH)3的化学性质与Al(OH)3 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为(用离子方程式表示)。
②下列溶液中可以最佳代替上述流程中Na2S2O3溶液的是(填字母)。
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1 mol Na2S2O3转移0.8 mol e- , 则加入Na2S2O3溶液时发生反应的离子方程式为。
四、综合题
-
19. 二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。(1)、Ⅰ.从热力学角度研究反应
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5 kJ·mol-1
S(s)+O2(g) SO2(g) ΔH3=-296.0 kJ·mol-1
写出CO 还原SO2的热化学方程式:。
(2)、关于CO还原SO2的反应,下列说法正确的是______。A、在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态 B、平衡状态时,2v正(CO)=v逆(SO2) C、其他条件不变,增大SO2的浓度,CO的平衡转化率增大 D、在恒温恒压的容器中,向达到平衡状态的体系中充入N2 , SO2的平衡转化率不变(3)、Ⅱ.NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:反应a:C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ/mol
反应b:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间(min)
浓度(mol·L-1)
0
10
20
30
40
50
NO
1.00
0.58
0.40
0.40
0.48
0.48
N2
0
0.21
0.30
0.30
0.36
0.36
①0~10min内,NO的平均反应速率v(NO)= , 当升高反应温度,该反应的平衡常数K(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
(4)、①某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因;在1100kPa时,NO2的体积分数为。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数Kp=(计算表达式表示);已知:气体分压(P分)=气体总压(P总)×体积分数。
20. 有机物J属于大位阻醚系列中的一种物质,在有机化工领域具有十分重要的价值。2018年我国首次使用α-溴代羰基化合物合成大位阻醚J,其合成路线如图所示:
已知:
 +R-OH
+R-OH 
回答下列问题:
(1)、A的名称为。(2)、C→D的化学方程式为;E→F的反应类型为 。(3)、H中含有的官能团名称为;J的分子式为 。(4)、化合物X是D的同分异构体,化合物X能与氢氧化钠溶液反应,其中核磁共振氢谱有3组峰且峰面积之比为1:1:6的结构简式为:(写出一种即可)。(5)、参照题中合成路线图。设计以甲苯和 为原料来合成另一种大位阻醚
为原料来合成另一种大位阻醚  的路线:(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,在箭头上注明试剂和反应条件)。
的路线:(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,在箭头上注明试剂和反应条件)。 五、填空题
-
21. Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。(1)、基态Co原子的价电子排布式为(2)、已知HN3是一种弱酸,其在水溶液中的电离方程式为HN3 H++N3- , 与N3-互为等电子体的一种分子为: , N3-离子杂化类型为。(3)、Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是 , 1mol该配离子中所含σ键的数目为 , 配位体NH3的空间构型为: 。(4)、某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN- , K+位于立方体的某恰当位置上。据此可知该晶体的化学式为 , 立方体中Fe2+间连接起来形成的空间构型是。(5)、NiO的晶体结构如下图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为。
 (6)、一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为g(用含a、NA的代数式表示)。
(6)、一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如下图),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为g(用含a、NA的代数式表示)。
-
-