湖南省邵阳市2019-2020学年高一下学期化学期末考试试卷
试卷更新日期:2020-09-11 类型:期末考试
一、选择题(本题包括14小题,每题3分,共42分。每小题只有一个选项符合题意)
-
1. 2020年10月,我国将实施嫦娥五号登月计划,实现月面无人采样返回。月球土壤中含有丰富的 He,则该原子中( )A、质量数为2 B、中子数为2 C、核外电子数为2 D、质子数为32. 下列物质是纯净物的是( )A、冰水混合物 B、氨水 C、铝热剂 D、盐酸3. 下列有关化学用语表示正确的是( )A、乙酸的分子式:CH3COOH B、乙烯的结构简式:CH2CH2 C、Na+的结构示意图:
 D、乙醇的比例模型:
D、乙醇的比例模型:  4. NA为阿伏加德罗常数,下列叙述正确的是( )A、18g水中含有的质子数为9NA B、0.1molNa+含有的电子数为NA C、常温常压下,71g氯气中含有的氯原子数为NA D、标准状况下,22.4LCCl4中含有的分子数为NA5. 下列有关元素周期表及其应用的叙述正确的是( )A、第IA族的元素全部是金属元素 B、在金属与非金属的分界处,可以找到半导体材料 C、0族元素的原子最外层电子数均为8,元素化合价均为0 D、元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共16纵行6. 下列叙述正确的是( )A、煤的气化和液化都是物理变化 B、燃料电池中通入燃气的一极为负极 C、用品红溶液不能鉴别CO2和SO2 D、24g镁与27g铝中,含有相同的质子数7. 下列化学反应的离子方程式书写正确的是( )A、碳酸钙溶解于盐酸:CO32-+2H+=CO2↑+H2O B、单质铁与稀硫酸反应:2Fe+6H+=3H2↑+2Fe3+ C、氨气通入醋酸溶液:CH3COOH+NH3=CH3COO-+NH4+ D、过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O8. 下列叙述错误的是( )A、16O与18O互为同位素 B、O2与O3互为同素异形体 C、CH3CH2CH3与CH3CH2CH2CH3互为同系物 D、
4. NA为阿伏加德罗常数,下列叙述正确的是( )A、18g水中含有的质子数为9NA B、0.1molNa+含有的电子数为NA C、常温常压下,71g氯气中含有的氯原子数为NA D、标准状况下,22.4LCCl4中含有的分子数为NA5. 下列有关元素周期表及其应用的叙述正确的是( )A、第IA族的元素全部是金属元素 B、在金属与非金属的分界处,可以找到半导体材料 C、0族元素的原子最外层电子数均为8,元素化合价均为0 D、元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共16纵行6. 下列叙述正确的是( )A、煤的气化和液化都是物理变化 B、燃料电池中通入燃气的一极为负极 C、用品红溶液不能鉴别CO2和SO2 D、24g镁与27g铝中,含有相同的质子数7. 下列化学反应的离子方程式书写正确的是( )A、碳酸钙溶解于盐酸:CO32-+2H+=CO2↑+H2O B、单质铁与稀硫酸反应:2Fe+6H+=3H2↑+2Fe3+ C、氨气通入醋酸溶液:CH3COOH+NH3=CH3COO-+NH4+ D、过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O8. 下列叙述错误的是( )A、16O与18O互为同位素 B、O2与O3互为同素异形体 C、CH3CH2CH3与CH3CH2CH2CH3互为同系物 D、 与
与  互为同分异构体
9. 为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述错误的是( )
互为同分异构体
9. 为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述错误的是( ) A、A中锥形瓶中生成CO2气体 B、B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体 C、C中装Na2SiO3溶液,预期现象是出现白色沉淀 D、HCl、H2CO3、H2SiO3的酸性依次减弱10. 下列金属的冶炼方法错误的是( )A、电解熔融氯化铝制取金属铝 B、加热分解氧化汞制取金属汞 C、金和铂采用物理法提炼 D、用热还原法制取铁11. 下列叙述错误的是( )A、己烷有5种同分异构体 B、苯在空气中不易燃烧完全,燃烧时冒浓烟 C、甲烷和氯气的混合气体在光照条件下反应,生成纯净的CH3Cl D、乙烯通入溴的四氯化碳溶液中,溶液褪色,是发生了加成反应12. 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述错误的是( )
A、A中锥形瓶中生成CO2气体 B、B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体 C、C中装Na2SiO3溶液,预期现象是出现白色沉淀 D、HCl、H2CO3、H2SiO3的酸性依次减弱10. 下列金属的冶炼方法错误的是( )A、电解熔融氯化铝制取金属铝 B、加热分解氧化汞制取金属汞 C、金和铂采用物理法提炼 D、用热还原法制取铁11. 下列叙述错误的是( )A、己烷有5种同分异构体 B、苯在空气中不易燃烧完全,燃烧时冒浓烟 C、甲烷和氯气的混合气体在光照条件下反应,生成纯净的CH3Cl D、乙烯通入溴的四氯化碳溶液中,溶液褪色,是发生了加成反应12. 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述错误的是( )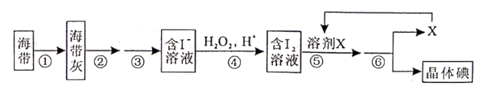 A、操作①在坩埚中进行 B、操作②③中所用到的玻璃仪器有:玻璃棒、烧杯、漏斗 C、每消耗1molH2O2转移电子数为2NA D、溶剂X可选用酒精或苯13. 某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素,实验装置与记录如下:
A、操作①在坩埚中进行 B、操作②③中所用到的玻璃仪器有:玻璃棒、烧杯、漏斗 C、每消耗1molH2O2转移电子数为2NA D、溶剂X可选用酒精或苯13. 某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素,实验装置与记录如下:
实验序号
①
②
③
④
⑤
过氧化氢溶液的浓度(%)
30
15
30
30
30
过氧化氢溶液的体积(mL)
6
6
6
6
6
水槽中水的温度(℃)
20
70
70
20
20
锥形瓶中的物质
--------
------
------
0.5gMnO2
0.5gFeCl3
60min内产生氧气(mL)
0.0
4.5
12.1
800.0
650.0
下列叙述错误的是( )
A、根据该实验方案,可以得出过氧化氢溶液的浓度对反应速率的影响 B、通过实验①和③可以得出:在相同条件下,温度越高,过氧化氢的分解速率越大 C、实验可以通过测产生相同体积氧气(相同条件)所需的时间来比较过氧化氢的分解速率,时间越长,分解速率越快 D、通过实验④和⑤可以得出MnO2对过氧化氢分解的催化效果比FeCl3好;催化剂是通过降低反应的活化能来加快反应速率14. 2018年5月美国研究人员成功实现了在常温常压下用氮气和水生产氨,原理如下图所示:
下列叙述正确的是( )
A、H+向a极区移动 B、图中能量转化方式只有2种 C、b极上每产生22.4LNH3流过电极的电子数为3NA D、a极发生的电极反应为:2H2O-4e-=O2↑+4H+二、非选择题(本题包括4小题,共58分)
-
15. 下表是元素周期表的一部分,其中每个数字序号代表一种元素。

请按要求回答下列问题
(1)、写出②的元素名称;(2)、元素的非金属性:⑥⑦(填“>”或“<”);(3)、上表8种元素中,金属性最强的元素是(填元素符号);(4)、⑦元素的最高价氧化物对应的水化物是(填化学式);(5)、③和④两元素形成的淡黄色固体物质含有的化学键的类型是;⑤和⑦两元素形成的简单化合物的电子式是;
(6)、元素③与⑥的简单氢化物中,沸点较低的是(填化学式);(7)、③、④、⑤简单离子的半径由大到小的顺序是 (填离子符号);(8)、①和②两元素形成分子的空间结构可能是(填字母)。 16. 下图是实验室制备乙酸乙酯的装置图,在试管a中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按图连接好装置,用酒精灯缓慢加热,回答下列问题:
16. 下图是实验室制备乙酸乙酯的装置图,在试管a中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按图连接好装置,用酒精灯缓慢加热,回答下列问题: (1)、实验室制备乙酸乙酯的化学方程式是;(2)、浓硫酸的作用是、;(3)、试管b中的试剂是 ,其作用是 (填字母);
(1)、实验室制备乙酸乙酯的化学方程式是;(2)、浓硫酸的作用是、;(3)、试管b中的试剂是 ,其作用是 (填字母);A.中和乙酸并吸收挥发出来的乙醇
B.加速酯的生成,提高其产率
C.降低乙酸乙酯在该溶液中的溶解度,有利于分层
(4)、在实验中球形干燥管除了起冷凝作用外,另一个重要作用是;(5)、将试管b中的溶液与乙酸乙酯分离需要进行的实验操作是。17. 某工厂的废金属屑中主要成分为Fe和Cu,此外还含有少量Fe2O3 , 该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠) 等产品。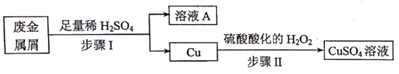 (1)、Fe2O3与稀H2SO4反应的离子方程式为 , 步骤Ⅰ中涉及到的分离操作是。(2)、请设计实验检验溶液A中的金属阳离子,写出实验操作、现象和结论:;(3)、步骤Ⅱ中,参加反应的Cu与H2O2的物质的量之比为;(4)、步骤Ⅰ所得溶液A经进一步处理可制得Na2FeO4 , 流程如下:
(1)、Fe2O3与稀H2SO4反应的离子方程式为 , 步骤Ⅰ中涉及到的分离操作是。(2)、请设计实验检验溶液A中的金属阳离子,写出实验操作、现象和结论:;(3)、步骤Ⅱ中,参加反应的Cu与H2O2的物质的量之比为;(4)、步骤Ⅰ所得溶液A经进一步处理可制得Na2FeO4 , 流程如下: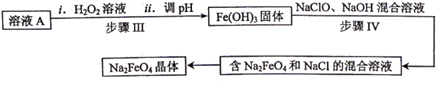
写出步骤Ⅳ中反应的离子方程式。
18. 已知H2与I2反应可生成HI。请回答下列问题:
在容积为2L的恒温恒容密闭容器中通入2molH2和b molI2蒸气,反应过程的能量变化如图1所示,部分物质的物质的量随反应时间的变化关系如图2所示。
(1)、由图1中曲线变化可知,该反应为(填“放热”或“吸热”)反应;(2)、图2中甲为;(3)、试写出该反应的化学方程式:;(4)、从反应开始到平衡,反应速率v(H2)=;(5)、反应达到平衡时,H2的转化率为;(6)、当b= 时,H2与I2的转化率相等;(7)、5min时,v正(H2) v逆(H2)(填“>”、“<”或“=”);(8)、下列叙述能说明该反应已达到平衡状态的是 。A、v正(HI)=2v逆(I2) B、反应速率:v(H2)=v(I2)=0.5v(HI) C、一个H-H键断裂的同时有两个H-I键断裂 D、温度和体积一定时,某一生成物浓度不再变化 E、温度和体积一定时,混合气体的颜色不再发生变化 F、温度和体积一定时,混合气体的平均相对分子质量不再变化 G、温度和压强一定时,混合气体的密度不再发生变化