专题18:电化学腐蚀及防护
试卷更新日期:2020-09-09 类型:一轮复习
一、单选题
-
1. 下列情形中,相同材质的铁最不易被腐蚀的是( )A、
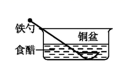 B、
B、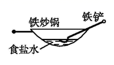 C、
C、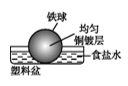 D、
D、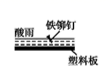 2. 考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如下图所示:
2. 考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如下图所示: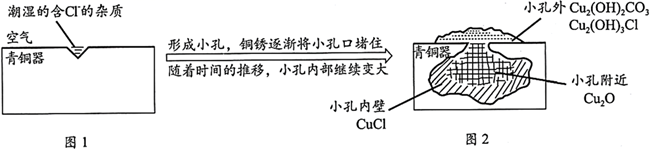
已知:2CuCl+H2O Cu2O+2HCl
下列分析错误的是( )
A、氧气是正极反应物 B、铜锈的成分与氧气浓度、pH有关 C、图2中,Cl-从小孔内向小孔外移动 D、青铜中的锡也会发生电化学腐蚀3. 下列有关电化学装置不能达到相应实验目的的是( )A、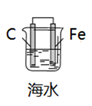 模拟吸氧腐蚀
B、
模拟吸氧腐蚀
B、 电解法制氯气
C、
电解法制氯气
C、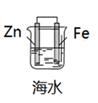 铁的防护
D、
铁的防护
D、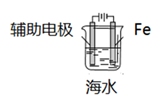 外加电流的阴极保护法
4. 关于下列装置,叙述不正确的是( )
外加电流的阴极保护法
4. 关于下列装置,叙述不正确的是( )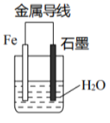 A、石墨电极反应式: O2+4H++4e-=2H2O B、温度计的示数会上升 C、加入少量NaCl ,会加快 Fe 生锈 D、加入 HCl,石墨电极反应式: 2H++2e-=H2↑5. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A、石墨电极反应式: O2+4H++4e-=2H2O B、温度计的示数会上升 C、加入少量NaCl ,会加快 Fe 生锈 D、加入 HCl,石墨电极反应式: 2H++2e-=H2↑5. 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整6. 下列说法中正确的是( )A、在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 C、纯银在空气中久置变黑发生的是电化学腐蚀 D、阴极电保护法是将被保护的金属与外加电源的正极相连7. 关于下列各装置图的叙述中,不正确的是( )
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、高硅铸铁的作用是作为损耗阳极材料和传递电流 D、通入的保护电流应该根据环境条件变化进行调整6. 下列说法中正确的是( )A、在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 C、纯银在空气中久置变黑发生的是电化学腐蚀 D、阴极电保护法是将被保护的金属与外加电源的正极相连7. 关于下列各装置图的叙述中,不正确的是( ) A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 B、装置②的总反应是:Cu+2Fe3+ = Cu2++2Fe2+ C、装置③中钢闸门应与外接电源的负极相连 D、装置④中的铁钉几乎没被腐蚀8. 下列金属防腐措施中,利用原电池原理的是( )A、在金属表面喷漆 B、在金属中加入一些铬或镍制成合金 C、在轮船的壳体水线以下部分装上锌块 D、使金属表面生成致密稳定的氧化物保护膜9. 下列关于电解的知识叙述中,错误的是( )
A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 B、装置②的总反应是:Cu+2Fe3+ = Cu2++2Fe2+ C、装置③中钢闸门应与外接电源的负极相连 D、装置④中的铁钉几乎没被腐蚀8. 下列金属防腐措施中,利用原电池原理的是( )A、在金属表面喷漆 B、在金属中加入一些铬或镍制成合金 C、在轮船的壳体水线以下部分装上锌块 D、使金属表面生成致密稳定的氧化物保护膜9. 下列关于电解的知识叙述中,错误的是( )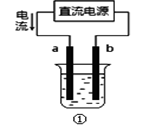
 A、用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液 B、工业上通过电解氯化钠溶液的方法制备金属钠 C、装置②的钢闸门应与外接电源的负极相连 D、向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极10. 利用下图装置进行实验,开始时,a、b两处液面相平,密封放置一段时间后,下列有关说法正确的是 ( )
A、用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液 B、工业上通过电解氯化钠溶液的方法制备金属钠 C、装置②的钢闸门应与外接电源的负极相连 D、向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极10. 利用下图装置进行实验,开始时,a、b两处液面相平,密封放置一段时间后,下列有关说法正确的是 ( ) A、a管发生析氢腐蚀,b管发生吸氧腐蚀 B、一段时间后,b管液面高于a管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:11. 研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
A、a管发生析氢腐蚀,b管发生吸氧腐蚀 B、一段时间后,b管液面高于a管液面 C、a处溶液的pH增大,b处溶液的pH减小 D、a、b两处具有相同的电极反应式:11. 研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( ) A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H++2e-=H2↑12. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H++2e-=H2↑12. 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。①
②
③



在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是( )
A、对比②③,可以判定Zn保护了Fe B、对比①②,K3[Fe(CN)6]可能将Fe氧化 C、验证Zn保护Fe时不能用①的方法 D、将Zn换成Cu,用①的方法可判断Fe比Cu活泼二、综合题
-
13. 某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)、同学们利用下表中装置进行实验并记录。装置
编号
电极A
溶液B
操作及现象
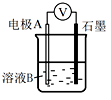
Ⅰ
Fe
pH=2的H2SO4
连接装置后,石墨表面产生无色气泡;电压表指针偏转
Ⅱ
Cu
pH=2的H2SO4
连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a
① 同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
② 针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
(2)、同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。编号
溶液B
操作及现象
Ⅲ
经煮沸的pH=2的 H2SO4
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b
Ⅳ
pH=2的H2SO4
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c
Ⅴ
pH=12的NaOH
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d
① 丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。
14. 银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如右图),一段时间后黑色褪去。回答下列问题: (1)、银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于腐蚀(填“化学”或“电化学”)。(2)、铝质容器作为极,银器的电极反应式为。(3)、处理过程中总反应的化学方程式为。(4)、若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为。15. 金属的腐蚀和防护在我们的生活中很常见。(1)、下图是为了减缓海水对钢闸门A、C的腐蚀而采取的措施,其中图1利用B的金属性比铁强来保护A,该方法称为法;若采用图2所示原理来减缓钢闸门C的腐蚀,则C应与直流电源的(填“正极”或“负极”)相连。
(1)、银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于腐蚀(填“化学”或“电化学”)。(2)、铝质容器作为极,银器的电极反应式为。(3)、处理过程中总反应的化学方程式为。(4)、若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为。15. 金属的腐蚀和防护在我们的生活中很常见。(1)、下图是为了减缓海水对钢闸门A、C的腐蚀而采取的措施,其中图1利用B的金属性比铁强来保护A,该方法称为法;若采用图2所示原理来减缓钢闸门C的腐蚀,则C应与直流电源的(填“正极”或“负极”)相连。 (2)、为除去银器表面的硫化银(Ag2S),可采用如下方法:向一个铝制容器中加入食盐溶液,将银器浸人食盐溶液中,使银器与铝接触良好。过一段时间,银器表面变为银白色,并有H2S气体和少量白色絮状沉淀生成,则正极的电极反应式为 。(3)、青铜器在潮湿环境中发生电化学腐蚀的原理如图。
(2)、为除去银器表面的硫化银(Ag2S),可采用如下方法:向一个铝制容器中加入食盐溶液,将银器浸人食盐溶液中,使银器与铝接触良好。过一段时间,银器表面变为银白色,并有H2S气体和少量白色絮状沉淀生成,则正极的电极反应式为 。(3)、青铜器在潮湿环境中发生电化学腐蚀的原理如图。
①腐蚀过程中,负极是 (填“a”“b”或“c”)。
②已知环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈[Cu2(OH)3Cl],该反应的离子方程式为。
16. 某小组按图1所示的装置探究铁的吸氧腐蚀。 (1)、图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向。(2)、正极反应式为 , 负极反应式为。(3)、按图1装置实验,约8 min时才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是。
(1)、图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向。(2)、正极反应式为 , 负极反应式为。(3)、按图1装置实验,约8 min时才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是。a.用纯氧气代替具支试管内的空气
b.将食盐水浸泡过的铁钉表面撒上铁粉和碳粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水