专题16:原电池
试卷更新日期:2020-09-09 类型:一轮复习
一、单选题
-
1. 下列装置中能构成原电池的是( )A、
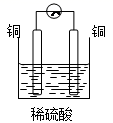 B、
B、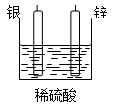 C、
C、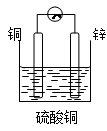 D、
D、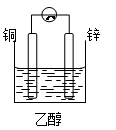 2. 锌铜原电池装置如图所示,下列说法正确的是( )
2. 锌铜原电池装置如图所示,下列说法正确的是( )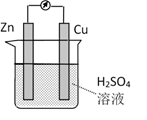 A、Cu是负极 B、反应一段时间后,溶液显蓝色 C、Zn棒发生反应:Zn-2e-=Zn2+ D、该装置实现电能向化学能的转化3. 液体燃料电池相比于气体燃料电池具有体积小等优点:一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
A、Cu是负极 B、反应一段时间后,溶液显蓝色 C、Zn棒发生反应:Zn-2e-=Zn2+ D、该装置实现电能向化学能的转化3. 液体燃料电池相比于气体燃料电池具有体积小等优点:一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )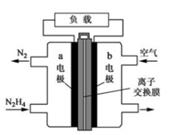 A、b极发生氧化反应 B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C、放电时,电子从b极经过负载流向a极 D、其中的离子交换膜需选用阳离子交换膜4. 下列各组材料中,不能组成原电池的是( )
A、b极发生氧化反应 B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C、放电时,电子从b极经过负载流向a极 D、其中的离子交换膜需选用阳离子交换膜4. 下列各组材料中,不能组成原电池的是( ) A、A B、B C、C D、D5. 电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn-2e-+2OH-=Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-=2Ag+2OH- , 总反应式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2下列说法错误的是( )A、锌是负极,氧化银是正极 B、锌发生氧化反应,氧化银发生还原反应 C、溶液中OH-向正极移动,K+、H+向负极移动 D、随着电极反应的不断进行,电解质溶液的pH会增大6. 下列根据反应Zn +Cu2+ =Zn2+ + Cu设计的原电池不符合该反应的是( )A、
A、A B、B C、C D、D5. 电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn-2e-+2OH-=Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-=2Ag+2OH- , 总反应式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2下列说法错误的是( )A、锌是负极,氧化银是正极 B、锌发生氧化反应,氧化银发生还原反应 C、溶液中OH-向正极移动,K+、H+向负极移动 D、随着电极反应的不断进行,电解质溶液的pH会增大6. 下列根据反应Zn +Cu2+ =Zn2+ + Cu设计的原电池不符合该反应的是( )A、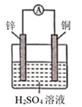 B、
B、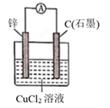 C、
C、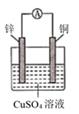 D、
D、 7. 已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。
7. 已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。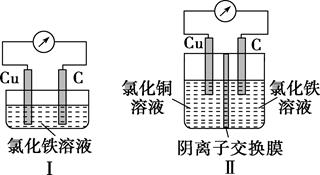
下列说法正确的是( )
A、Ⅰ和Ⅱ的电池反应不同 B、Ⅰ和Ⅱ的能量转化形式不同 C、Ⅰ的电流效率低于Ⅱ的电流效率 D、放电一段时间后,Ⅰ、Ⅱ中都只含1种溶质8. 在通风橱中进行下列实验:步骤


现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色
气泡后,迅速停止
Fe、Cu接触后,其表面
均产生红棕色气泡
下列说法中,错误的是( )
A、Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2 B、Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 C、对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 D、针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化9. 用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是( )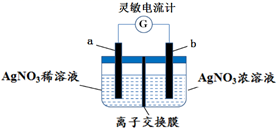 A、b极电极反应式为Ag–e–= Ag+ B、离子交换膜为阴离子交换膜 C、去掉离子交换膜,电流表仍然有电流通过 D、电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边10. 如图所示装置中,小试管内为红墨水,U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不正确的是( )
A、b极电极反应式为Ag–e–= Ag+ B、离子交换膜为阴离子交换膜 C、去掉离子交换膜,电流表仍然有电流通过 D、电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边10. 如图所示装置中,小试管内为红墨水,U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不正确的是( )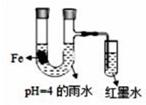 A、生铁片中的铁是原电池的负极,发生氧化反应生成Fe2+ B、开始时雨水酸性较强,生铁片发生析氢腐蚀 C、墨水液面回升时,正极反应式为:O2+2H2O+4e―=4OH- D、如果将铁片换成铜片,也会出现开始小试管中的导管内的液面下降,一段时间后导管内的液面回升的现象11. 某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是( )
A、生铁片中的铁是原电池的负极,发生氧化反应生成Fe2+ B、开始时雨水酸性较强,生铁片发生析氢腐蚀 C、墨水液面回升时,正极反应式为:O2+2H2O+4e―=4OH- D、如果将铁片换成铜片,也会出现开始小试管中的导管内的液面下降,一段时间后导管内的液面回升的现象11. 某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是( )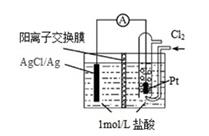 A、正极反应式为 AgCl + e-= Ag + Cl- B、放电时,交换膜右侧溶液中有大量白色沉淀生成 C、若用 NaCl 溶液代替盐酸,则电池总反应随之改变 D、当外电路中转移 0.1mol e-时,阳离子交换膜左侧溶液中约减少 0.2mol 离子12. 根据原电池原理,有人利用CH4 和 O2的反应,在 KOH 溶液中用铂作电极设计出燃料电池。关于该燃料电池的下列几种说法中正确的是( )
A、正极反应式为 AgCl + e-= Ag + Cl- B、放电时,交换膜右侧溶液中有大量白色沉淀生成 C、若用 NaCl 溶液代替盐酸,则电池总反应随之改变 D、当外电路中转移 0.1mol e-时,阳离子交换膜左侧溶液中约减少 0.2mol 离子12. 根据原电池原理,有人利用CH4 和 O2的反应,在 KOH 溶液中用铂作电极设计出燃料电池。关于该燃料电池的下列几种说法中正确的是( )①理论上每消耗标准状况下 22.4L 的CH4 , 可以向外电路提供 8mole-
②负极上是 O2 获得电子,电极反应式为O2+4e-+2H2O=4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的 pH 不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极会出现淡蓝色火焰
⑦电解质溶液中 OH-向负极移动,K+向正极移动
⑧该电池的总反应为CH4+2O2=CO2+2H2O
A、①④⑤⑦ B、①③④⑧ C、②③⑥⑧ D、②⑤⑦⑧二、填空题
-
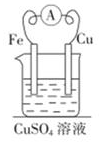
13. 由铜、铁和硫酸铜溶液组成的原电池中,作正极的是 , 正极的电极反应式为;作负极的是 , 电子由(填“正”或“负”,下同)极经导线移向极,总反应的离子方程式为。
 14. 原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
14. 原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置: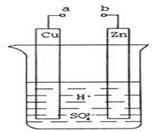
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。
三、综合题
-
15. 在铜、锌、稀硫酸构成的原电池中(如图所示)。
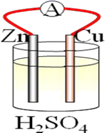 (1)、负极是(填“铜”或“锌”),电子(填“失去”或“得到”),发生反应(填“氧化”或“还原”),电极反应方程式;正极是(填“铜”或“锌”)电子(填“失去”或“得到”),发生反应(填“氧化”或“还原”),电极反应方程式。(2)、电流由流向(填“铜”或“锌),铜片上观察到的现象是。16. A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)、负极是(填“铜”或“锌”),电子(填“失去”或“得到”),发生反应(填“氧化”或“还原”),电极反应方程式;正极是(填“铜”或“锌”)电子(填“失去”或“得到”),发生反应(填“氧化”或“还原”),电极反应方程式。(2)、电流由流向(填“铜”或“锌),铜片上观察到的现象是。16. A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。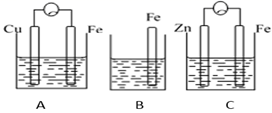 (1)、B中反应的离子方程式为。(2)、A中作正极的金属是 , 该电极上看到的现象为。(3)、C中作负极的金属是 , 该电极反应方程式为。(4)、现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发生反应。(填“氧化”或“还原”)。17. 以下是两个原电池的示意图,其中图二由锌片、铜片和200mL稀H2SO4组成。
(1)、B中反应的离子方程式为。(2)、A中作正极的金属是 , 该电极上看到的现象为。(3)、C中作负极的金属是 , 该电极反应方程式为。(4)、现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发生反应。(填“氧化”或“还原”)。17. 以下是两个原电池的示意图,其中图二由锌片、铜片和200mL稀H2SO4组成。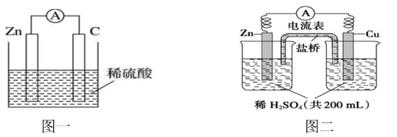 (1)、写出图一原电池的负极的电极反应式:。反应过程中,SO42-移向电极;(2)、当图一的电解质溶液为NaCl溶液时,该电池的正极的电极反应式为:;(3)、图二的原电池放电一段时间后,当在铜片上放出2.24L(标准状况)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗g锌,此时转移的电子数目为 ,原硫酸的物质的量浓度是 (设溶液体积不变)。18.(1)、下图是某化学兴趣小组探究化学能转变为电能的装置。
(1)、写出图一原电池的负极的电极反应式:。反应过程中,SO42-移向电极;(2)、当图一的电解质溶液为NaCl溶液时,该电池的正极的电极反应式为:;(3)、图二的原电池放电一段时间后,当在铜片上放出2.24L(标准状况)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗g锌,此时转移的电子数目为 ,原硫酸的物质的量浓度是 (设溶液体积不变)。18.(1)、下图是某化学兴趣小组探究化学能转变为电能的装置。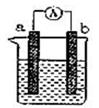
若依据氧化还原反应:Cu+2Fe3+=Cu2++2Fe2+设计原电池,电极a为石墨、则电极b为电池的极,发生的电极反应式为: , 电极a上发生的电极反应为(填“氧化”或“还原”)反应。
(2)、燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计如图为某种甲烷燃料电池示意图,工作时电子流向如图所示。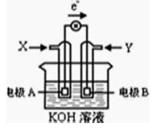
写出电极A的电极方程式 , 电极A附近pH如何变化? (填“变大”或“变小”)。
(3)、Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4--SOCl2。电池的总反应可表示为:4Li+2SOCl2——4LiCl+S+SO2。已知SOCl2会与水反应有刺激性气味的气体生成:SOCl2+H2O=2HCl↑+SO2↑。请回答下列问题:电池的负极材料为;电池正极发生的电极反应式为;组装该电池必须在无水、无氧的条件下进行,原因是。