浙教版科学2020中考真题分类汇编 常见的化学反应
试卷更新日期:2020-08-29 类型:二轮复习
一、单选题
-
1. 下列化学反应中,属于化合反应的是( )A、CaCO3 CaO+CO2↑ B、H2O+CO2=H2CO3 C、H2+CuO H2O+Cu D、BaCl2 +H2SO4=BaSO4↓+2HCl2. 下图是一定量的B2和AB在一定条件下混合以及混合结果的模型,则( )
 A、反应得到的生成物有两种 B、反应前后元素化合价不变 C、参加反应的两种分子个数比为3:2 D、该反应为化合反应3. 某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。
A、反应得到的生成物有两种 B、反应前后元素化合价不变 C、参加反应的两种分子个数比为3:2 D、该反应为化合反应3. 某化学反应的反应物和生成物的微观示意图及反应前后的质量如下表所示。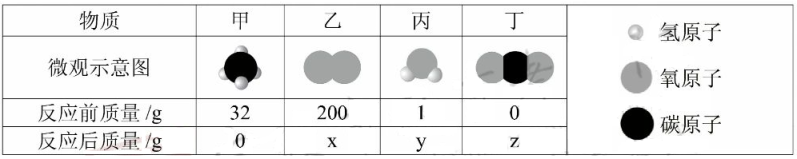
下列有关该反应的说法正确的是( )
A、甲物质由碳原子和氢原子直接构成 B、该反应属于置换反应 C、参加反应的反应物分子个数比为1:1 D、x+y+z=2334. 伏打电堆于1800年问世,它利用化学反应将化学能转化为电能,其中的一条化学反应是:2Zn+O2+2H2O=2Zn(OH)2 , 该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应5. 下列实验中,能证明燃烧需要氧气的是( )A、 B、
B、 C、
C、 D、
D、 6. 与图示微观变化相符的化学反应是( )
6. 与图示微观变化相符的化学反应是( ) A、2CO+O2 2CO2 B、H2+CuO H2O+Cu C、2H2+O2 2H2O D、H2CO3 H2O+CO2↑7. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )
A、2CO+O2 2CO2 B、H2+CuO H2O+Cu C、2H2+O2 2H2O D、H2CO3 H2O+CO2↑7. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )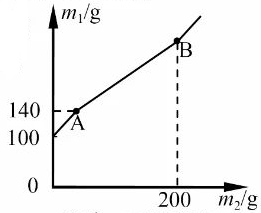 A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g二、填空题
-
8. 18世纪前后,人们把元素等同于一种在化学变化中不可再分的物质,即单质。“燃素说”和“燃烧的氧化学说”一度成为科学家争论的焦点。
材料一:1723年,施塔尔提出“燃素说”:燃素也是一种元素,燃素存在于一切可燃物中。如金属含有燃素,金属燃烧时金属释放燃素后成为金属灰(实际是金属氧化物);金属灰与燃素结合又会重新变回金属。
材料二:1766年,卡文迪许制得氢气并认为它是燃素;1773年,舍勒研究发现,可燃物燃烧需要一种他称为“火空气”的单质参与;1784年前,人们认为水是一种元素;1796年,普里斯特利制得可在“脱燃素气”中燃烧的“可燃空气”,也把它当作燃素。
材料三:1777年,拉瓦锡建立了“燃烧的氧化学说”,认为可燃物中不存在燃素;1801年,克鲁克香克证明了普里斯特利所谓的“可燃空气”是一氧化碳,从而结束了“燃素说”与“燃烧的氧化学说”之争。
(1)、用你所学的燃烧条件分析,材料二中的“火空气”是。(2)、材料三中的“可燃空气”一氧化碳属于纯净物中的 , 所以不可能是燃素。(3)、“燃素说”自提出后就引起争议。下列是当时科学家分析的事实或现象,用“燃素说”解释不合理的是。(可多选)选项
事实或现象
用“燃素说”解释
A
金属成分比金属灰简单
因为金属燃烧时燃素从金属中逸出
B
加热金属灰通入氢气,金属灰变回金属
因为氢气是燃素
C
木炭与金属灰一起加热变回金属
因为木炭富含燃素
D
铜在空气中加热后质量增加
因为金属铜中含有燃素,加热后有燃素逸出
E
燃素(氢气)与脱燃素气(氧气)结合成为水
因为水是一种元素
9. 北宋张潜在其《浸铜要略序》一书中对铜的冶炼有如下记载:“山麓有胆泉,土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜 (1)、书中提及的“胆泉”为硫酸铜溶液,“浸铁”即将铁放入其中,写出此冶 炼铜方法中生成铜的化学方程式(2)、若“浸铁”前后溶液中存在的离子种类如图所示,其中 “
(1)、书中提及的“胆泉”为硫酸铜溶液,“浸铁”即将铁放入其中,写出此冶 炼铜方法中生成铜的化学方程式(2)、若“浸铁”前后溶液中存在的离子种类如图所示,其中 “ ”“
”“ ”“
”“ ”表示不同种类的离子,则
”表示不同种类的离子,则  ” 表示填写离子符号) 10. 某品牌新能源电动汽车使用磷酸铁锂电池,其反应原理: 。该电池具有容量大、续航能力强的特点。(1)、LiFePO4 , 中铁元素与氧元素的质量比为。(2)、该电池充电时发生的化学反应属于(填基本反应类型)。11. 某同学为了研究生石灰CaO露置于空气中变质情况,设计如下实验,请通过分析计算:
” 表示填写离子符号) 10. 某品牌新能源电动汽车使用磷酸铁锂电池,其反应原理: 。该电池具有容量大、续航能力强的特点。(1)、LiFePO4 , 中铁元素与氧元素的质量比为。(2)、该电池充电时发生的化学反应属于(填基本反应类型)。11. 某同学为了研究生石灰CaO露置于空气中变质情况,设计如下实验,请通过分析计算:取10克生石灰 粉末A质量为12克 气体B 沉淀质量为2.5克
(1)、生成气体B的质量为。(2)、粉末A的成分除CaO外还有。(写化学式)(3)、粉末A中CaO质量分数是。(结果精确到0.1%)三、实验探究题
-
12. 利用加热高锰酸钾的方法,验证化学反应中质量守恒定律。如图,小科将适量高锰酸钾装入试管,塞入一团棉花并测出试管、棉花与药品的总质量为m。加热使之充分反应后,测得量筒中气体体积为V,再次测得反应装置与物质总质量为m2,已知常温常压下氧气密度为p。据此请回答:
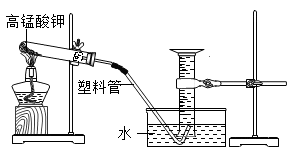 (1)、实验中用量筒收集气体的好处是。(2)、实验中,试管口内壁附着紫红色小液滴,请解释产生该现象的原因。(3)、根据实验数据计算发现: ,与质量守恒定律不符。造成这一实验结果的原因分析正确的是A、试管中高锰酸钾没有完全分解 B、导管口连续均匀冒气泡时才收集气体 C、未调节量筒内外液面相平就读数 D、停止加热时,先将导管移出水面,再熄灭酒精灯
(1)、实验中用量筒收集气体的好处是。(2)、实验中,试管口内壁附着紫红色小液滴,请解释产生该现象的原因。(3)、根据实验数据计算发现: ,与质量守恒定律不符。造成这一实验结果的原因分析正确的是A、试管中高锰酸钾没有完全分解 B、导管口连续均匀冒气泡时才收集气体 C、未调节量筒内外液面相平就读数 D、停止加热时,先将导管移出水面,再熄灭酒精灯四、解答题
-
13. 小科用如图所示的装置来测量某石灰石样品中碳酸钙的质量分数,注射器水平放置,夹持装置未画出。他在试管中加入1g石灰石样品和足量的稀盐酸(石灰石中其它成分不与稀盐酸反应产生气体),快速将连有注射器的橡皮塞塞紧试管口,实验结果如下表。(忽略活塞与筒壁之间的摩擦及温度变化对实验的影响)

 (1)、实验中判断石灰石和盐酸反应完的依据是。(2)、当时实验条件下二氧化碳的密度约为2g/L,请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。14. 某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生气的体积。
(1)、实验中判断石灰石和盐酸反应完的依据是。(2)、当时实验条件下二氧化碳的密度约为2g/L,请利用表格中的数据,根据化学方程式计算该石灰石样品中碳酸钙的质量分数。14. 某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生气的体积。 (1)、已知氢气的密度比空气小,难溶于水。应选择甲图中的装置进行制取和收集。(2)、乙图为检查发生装置气密性的操作,当观察到水中的导管口有产生,则表示该装置气密性良好。(3)、已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到0.01%)(4)、反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因(写出两点).15. 某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如下表:
(1)、已知氢气的密度比空气小,难溶于水。应选择甲图中的装置进行制取和收集。(2)、乙图为检查发生装置气密性的操作,当观察到水中的导管口有产生,则表示该装置气密性良好。(3)、已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到0.01%)(4)、反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因(写出两点).15. 某科学兴趣小组同学取8.5g铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g固体。为测定所得固体中各成分的含量,同学们将62.5g稀盐酸分五次加入到该固体中,得到数据如下表:次数
1
2
3
4
5
加入盐酸溶液质量/g
12.5
12.5
12.5
12.5
12.5
剩余固体质量/g
8.5
7.8
a
6.4
6.4
请分析计算:
(1)、表中a的值是。(2)、9.2g固体中铁的质量是g。(3)、稀盐酸的溶质质量分数是多少?(4)、与硫酸铜反应的铁的质量是多少?16. 面粉是制作美食的原材料。在发面团的过程中会生成酸而影响口味,为使食品更美味,可以加碱面处理。碱面的主要成分为碳酸钠(Na2CO3),为测定某品牌碱面中碳酸钠的质量分数,小金按照如图甲所示实验装置,利用碱面与盐酸反应生成二氧化碳气体的质量来计算碱面中碳酸钠的质量分数(杂质不与盐酸反应)。
完成下列问题:
(1)、为完成碳酸钠质量分数的测定实验,气体发生装置应选择图乙中的装置(填字母);(2)、小金各取11.0克碱面样品与一定量的稀盐酸进行三次实验,三次实验所采集的数据见下表。合理选择表中数据并计算碱面中碳酸钠的质量分数;实验次数
碱面样品质量/克
稀盐酸质量/克
二氧化碳质量/克
1
11.0
50.0
1.1
2
11.0
200.0
4.4
3
11.0
250.0
4.4
(3)、按照图甲实验装置测定的CO2气体质量,可能导致CO2质量测定结果偏小的原因 (写出一种即可)。17. “84消毒液”是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。(1)、“84消毒液”中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)(2)、现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌“84消毒液”进行配置,需加水多少升?(忽略混合前后溶液体积的变化)(3)、“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。浓度(mg/m3)
对人体的影响
3000
可立即麻痹呼吸中枢, 导致瞬间死亡
120-170
极为危险, 会引起急性肺水肿及肺炎
40-60
在1小时内便可致人严重中毒
通过计算分析,在10米3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响? (次氯酸钠与盐酸反应的化学方程式为: NaClO+2HCl=NaCl+Cl2↑+H2O)
18. 氢气的储存是科学研究热点之一。X是一种储存氢气的材料,取11.2gX在O2中完全燃烧后只生成8.0gCuO、8.0gMgO(1)、上述燃烧过程中消耗O2的质量为克。(2)、通过计算求X中各元素的原子个数比。(写出计算过程)
-