黑龙江省大庆市龙凤区(五四学制)2019-2020学年九年级上学期化学期中考试试卷
试卷更新日期:2020-09-01 类型:期中考试
一、单选题
-
1. 化学与人类生产生活息息相关,下列说法正确的是( )A、空气中N2的质量分数为78% B、溶液中的溶剂一定是水 C、日常生活中可用肥皂水鉴别硬水和软水 D、金、银、铜金属活动性顺序逐渐减弱2. 下列诗句 或名著事件的描述中既隐含物理变化又有化学变化的是( )A、伐薪烧炭南山中 B、陆虞侯火烧草料场 C、白玉为床金做马 D、千里冰封,万里雪飘3. 下列实验操作正确的是( )A、
 蒸发食盐水
B、
蒸发食盐水
B、 铁丝在氧气中燃烧
C、
铁丝在氧气中燃烧
C、 称量NaOH固体的质量
D、
称量NaOH固体的质量
D、 检验装置气密性
4. 下列关于反应的描述对应方程式完全正确的是( )A、铝的自我保护 4Al+3O2=2Al2O3 B、验证铜和银的活动性 Cu+2AgCl=CuCl2+2Ag C、高炉炼铁原理 Fe3O4+4CO 3Fe+4CO2 D、将铁片投入足量的稀盐酸中 2Fe+6HCl=2FeCl3+3H2↑5. 下列不能作为判断金属Mg 、Fe 、Cu三种金属活动性强弱的是( )A、在纯氧中燃烧的现象 B、与盐酸反应的快慢程度 C、金属导电性强弱 D、三种金属发现和利用的年代的先后顺序6. 许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )A、通过加热蒸发的方法提高75%酒精的浓度 B、将1gCaO投入到99g水中,溶质的质量分数大于1% C、常温下KNO3、Ca(OH)2的饱和溶液降温后仍是饱和溶液 D、将NaCl、蔗糖溶于水后,溶质均以分子形式存在7. 下列叙述错误的是( )A、工业上采用液化空气的方法制备氧气和氮气 B、金属与盐溶液发生置换反应后,溶液的质量一定增加 C、利用洗涤剂的乳化功能可洗去餐具上的油污 D、用铅锑合金制作保险丝,是因为熔点低8. 下列图像能正确反映对应变化关系的是( )A、
检验装置气密性
4. 下列关于反应的描述对应方程式完全正确的是( )A、铝的自我保护 4Al+3O2=2Al2O3 B、验证铜和银的活动性 Cu+2AgCl=CuCl2+2Ag C、高炉炼铁原理 Fe3O4+4CO 3Fe+4CO2 D、将铁片投入足量的稀盐酸中 2Fe+6HCl=2FeCl3+3H2↑5. 下列不能作为判断金属Mg 、Fe 、Cu三种金属活动性强弱的是( )A、在纯氧中燃烧的现象 B、与盐酸反应的快慢程度 C、金属导电性强弱 D、三种金属发现和利用的年代的先后顺序6. 许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )A、通过加热蒸发的方法提高75%酒精的浓度 B、将1gCaO投入到99g水中,溶质的质量分数大于1% C、常温下KNO3、Ca(OH)2的饱和溶液降温后仍是饱和溶液 D、将NaCl、蔗糖溶于水后,溶质均以分子形式存在7. 下列叙述错误的是( )A、工业上采用液化空气的方法制备氧气和氮气 B、金属与盐溶液发生置换反应后,溶液的质量一定增加 C、利用洗涤剂的乳化功能可洗去餐具上的油污 D、用铅锑合金制作保险丝,是因为熔点低8. 下列图像能正确反映对应变化关系的是( )A、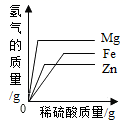 分别向相同质量的镁粉、铁粉、锌粉中加入等浓度稀硫酸
B、
分别向相同质量的镁粉、铁粉、锌粉中加入等浓度稀硫酸
B、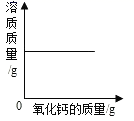 一定温度下,向饱和的氢氧化钙溶液中加入氧化钙固体
C、
一定温度下,向饱和的氢氧化钙溶液中加入氧化钙固体
C、 向一定量铁锈中加入稀盐酸
D、
向一定量铁锈中加入稀盐酸
D、 向一定量硝酸银溶液中加入铜粉
9. 如图为A,B,C三种不含结晶水的固体物质溶解度曲线.下列说法错误的是( )
向一定量硝酸银溶液中加入铜粉
9. 如图为A,B,C三种不含结晶水的固体物质溶解度曲线.下列说法错误的是( ) A、t1℃时,65gA的饱和溶液中含有溶质15g B、要从B的溶液中得到B,通常可采用蒸发溶剂的方法 C、除去A中含有少量的B,可采用冷却热饱和溶液的方法 D、在t2℃时,将A,C两种物质的饱和溶液升温到t3℃后,两种溶液中溶质的质量分数仍相等10. 化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
A、t1℃时,65gA的饱和溶液中含有溶质15g B、要从B的溶液中得到B,通常可采用蒸发溶剂的方法 C、除去A中含有少量的B,可采用冷却热饱和溶液的方法 D、在t2℃时,将A,C两种物质的饱和溶液升温到t3℃后,两种溶液中溶质的质量分数仍相等10. 化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
下列说法正确的是( )
A、固体丙中一定只含有银 B、四种金属活动性强弱顺序Zn、X、Cu、Ag C、滤液C中只含有Cu(NO3)2 D、固体甲中一定含有Cu和Ag,可能含有X二、填空题
-
11.(1)、地壳中含量居第二位的金属元素是。(写出元素符号)(2)、汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是。(3)、生活中降低水的硬度的方法是。(4)、航天煤油可由优质石油分离而来,这是利用石油中各成分的不同进行分离。(5)、生铁和钢都是铁的合金,主要区别是。12. 将宏观、微观及化学符号联系在一起是化学学科的特点。(1)、用化学用语表示:
①
 的微粒符号;
的微粒符号;②标出过氧化氢中氧元素的化合价。
(2)、医生用碘酒给病人皮肤上的伤口消毒,碘酒中的溶剂是(填化学式)。(3)、医用体温计中的物质是水银,该物质由(填具体微粒名称)构成。(4)、聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某聚合硫酸铁中铁离子与硫酸根离子的质量比为7:15,则b:a=。(5)、烟道气中含有大量CO2 , 经“捕捉”可用于生产甲醇(CH3OH)等产品。①“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液。所得溶液中溶质是。
②用“捕捉”CO2生产甲醇,反应的微观示意图如下:

该反应的化学方程式为。
13. 下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:温度/℃
0
20
40
60
80
100
溶解度/g
Ca(OH)2
0.19
0.17
0.14
0.12
0.09
0.08
NaOH
31
91
111
129
313
336
(1)、依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(填A或B)。 (2)、要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
(2)、要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。其中措施正确的是。
A ②④⑥ B ③④ C ①③⑤⑥ D ①②⑤⑥
(3)、20℃时,191g饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为。(4)、现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数乙甲(填“>”、“<”或“=”)。(5)、现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。三、流程题
-
14. 钛和钛合金被认为是21世纪重要的金属材料。钛合金与人体具有很好的“相容性”,可用于制造人造骨骼。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其工业流程示意图如下:

请回答:
(1)、钛合金属于(选填“混合物”、“纯净物”)。(2)、钛酸亚铁FeTiO4中钛的化合价为价。(3)、以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为。(4)、经高温冶炼得到金属钛,则参加反应的镁与生成钛的质量比为。(5)、氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2 2TiCl4+2X+6CO,则X的化学式为。四、推断题
-
15. A~I是初中化学中常见的物质。它们之间有如图所示的转化关系。

已知A为铝土矿的主成分,通常情况下F是一种液体,C、D、H、I为气体,H能参与绿色植物的光合作用,G为黑色固体。
请回答下列问题:
(1)、G的化学式是。(2)、H+单质碳→I,其反应条件是。(3)、F C+D中生成的C和D体积比。(4)、I+F(气体) H+D的化学方程式是。五、实验题
-
16. 化学兴趣小组的同学设计了用一氧化碳还原氧化铁的实验装置,如图所示,请回答下列问题。
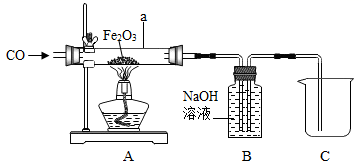 (1)、实验开始时,应(填“先加热再通CO”或“先通CO再加热”),a管中观察到的现象。(2)、B装置除了吸收CO2气体外,还。(3)、为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?(填“需要”或“不需要”),理由是。(4)、若a管中氧化铁全部还原成铁,冷却后称量铁的质量比反应前氧化铁的质量减少了6g,则加入a管中的氧化铁的质量是g17. 食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。医学上的生理盐水是用NaCl配置的。下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)、实验开始时,应(填“先加热再通CO”或“先通CO再加热”),a管中观察到的现象。(2)、B装置除了吸收CO2气体外,还。(3)、为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?(填“需要”或“不需要”),理由是。(4)、若a管中氧化铁全部还原成铁,冷却后称量铁的质量比反应前氧化铁的质量减少了6g,则加入a管中的氧化铁的质量是g17. 食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。医学上的生理盐水是用NaCl配置的。下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图: (1)、用上图表示的序号表示配制溶液的正确操作顺序。(2)、称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需量取水质量为。
(1)、用上图表示的序号表示配制溶液的正确操作顺序。(2)、称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见图,则需量取水质量为。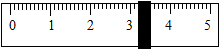 (3)、称量NaCl质量完毕放回砝码时,发现有一个砝码生锈,若其他操作步骤正确,则所配溶液的溶质质量分数(填“大于”、“小于”或“等于”)10%。(4)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是(填序号)。
(3)、称量NaCl质量完毕放回砝码时,发现有一个砝码生锈,若其他操作步骤正确,则所配溶液的溶质质量分数(填“大于”、“小于”或“等于”)10%。(4)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是(填序号)。A 食盐没有全部溶解即过滤 B 蒸发时食盐飞溅剧烈
C 蒸发后,所得精盐很潮湿 D 器皿上沾有的精盐没全部转移到称量纸上
(5)、同学们用上述配制好的溶液再进行配制85g的2%氯化钠溶液:①需要10%的氯化钠溶液g。
②配制过程中的操作步骤为:计算、、、装瓶。
(6)、用氯化钠和碳酸氢铵( )可制备碳酸氢钠和氯化铵( ),该反应可表示为: 。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8g 。理论上从溶液中析出晶体的质量为g。资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
物质
NaCl
溶液度/g
36.0
21.6
37.2
9.6
六、科学探究题
-
18. 小组同学通过学习发现甲烷的性质与氢气、一氧化碳有很多相似之处。
(提出问题)氢气、一氧化碳具有还原性,那么甲烷有没有还原性呢?
(查阅资料)1.无水硫酸铜是白色固体,吸收水分后变为蓝色。2.铁的氧化物与稀硫酸反应时无气体生成
(实验探究)为探究上述问题,设计如下装置并进行实验。
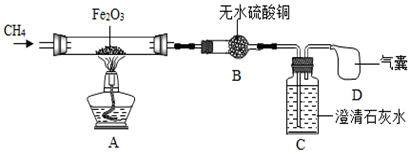 (1)、实验开始时先通一段时间甲烷的目的是。(2)、加热一段时间后,观察到A中硬质玻璃管中的固体粉末由红色全部变成黑色,取少量黑色粉末于试管中,加入适量稀盐酸,观察到(填实验现象),说明有铁生成;B中白色固体变蓝,说明有生成;C中澄清石灰水变浑浊,说明有二氧化碳生成。(3)、(结论)甲烷有还原性。若生成的黑色粉末全部是铁,甲烷还原氧化铁的化学方程式为。
(1)、实验开始时先通一段时间甲烷的目的是。(2)、加热一段时间后,观察到A中硬质玻璃管中的固体粉末由红色全部变成黑色,取少量黑色粉末于试管中,加入适量稀盐酸,观察到(填实验现象),说明有铁生成;B中白色固体变蓝,说明有生成;C中澄清石灰水变浑浊,说明有二氧化碳生成。(3)、(结论)甲烷有还原性。若生成的黑色粉末全部是铁,甲烷还原氧化铁的化学方程式为。七、计算题
-
19. 小明对废弃的易拉罐很有兴趣,他剪取W克镁铝合金的易拉罐,先用过量稀硫酸溶解,然后再向溶液中滴加一定量的NaOH溶液[已知:Al(OH)3+NaOH=NaAlO2+2H2O,Mg(OH)2不溶于NaOH溶液,假定易拉罐只由镁和铝组成],沉淀质量与滴加NaOH溶液质量关系如图所示。
 (1)、在N点时,溶液中的溶质为(填化学式);(2)、W克易拉罐中铝元素的质量?(写出计算过程)
(1)、在N点时,溶液中的溶质为(填化学式);(2)、W克易拉罐中铝元素的质量?(写出计算过程)
-
-
-