专题12:无机非金属材料
试卷更新日期:2020-08-27 类型:一轮复习
一、单选题
-
1. 硅及其化合物应用广泛,下列叙述正确的是( )A、硅酸钠可用于制备木材防火剂 B、SiO2既能和氢氧化钠溶液反应,也能和氢氟酸反应,是两性氧化物 C、光导纤维的主要成分是晶体硅 D、将CO2通入Na2SiO3溶液中有胶状沉淀生成,说明碳酸酸性比硅酸弱2. 是硅酸盐水泥的重要成分之一,其相关性质的说法错误的是( )A、可发生反应: B、具有吸水性,需要密封保存 C、能与 ,反应生成新盐 D、与足量盐酸作用,所得固体产物主要为3. 下列关于C、Si及其化合物结构与性质的论述错误的是( )A、键能 、 ,因此C2H6稳定性大于Si2H6 B、立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C、SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4 D、Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 键4. 中国是瓷器的故乡,有“瓷都”之称的江西景德镇出产的青花瓷是瓷器的代表,蓝紫色的硅酸铜钡(BaCuSi2O6)是瓷器加工中常用的颜料。下列说法正确的是( )A、瓷器属于新型无机硅酸盐产品 B、硅酸铜钡还可表示为BaO·CuO·2SiO2 C、石灰石、黏土是生产瓷器的主要原料 D、瓷器具有较高的强度与硬度5. 将过量的CO2通入下列溶液中,一定能产生沉淀的是( )A、氢氧化钡溶液 B、氯化钙溶液 C、硅酸钠溶液 D、次氯酸钠溶液6. 除去氧化铁中的二氧化硅,可采用的试剂是( )A、盐酸 B、硝酸 C、蒸馏水 D、烧碱溶液7. 二氧化硅属于酸性氧化物,理由是( )A、Si是非金属元素 B、SiO2对应的水化物是可溶性弱酸 C、SiO2与强碱反应生成盐和水 D、SiO2不能与酸反应8. 能证明碳酸的酸性比硅酸强的事实是( )A、二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸 B、在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3 Na2SiO3+CO2↑ C、二氧化硅的熔点比二氧化碳的熔点高 D、二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀9. 下列关于材料应用及成分表述错误的是( )
①三峡大坝使用了大量水泥,水泥是硅酸盐材料;②太阳能电池可采用二氧化硅材料制作,其应用有利于环保节能;③人造刚玉熔点很高,可用作高温耐火材料,主要成分是SiO2;④化学家采用玛瑙研钵研磨固体反应物进行合成,玛瑙的主要成分是SiO2
A、①④ B、②③ C、①③ D、②④10. 纯二氧化硅可用下列流程制得.下列说法错误的是( ) A、X可用作木材防火剂 B、步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+ Na2SO4 C、步骤Ⅱ中的稀硫酸可用CO2来代替 D、SiO2既能与盐酸反应,又能与氢氟酸反应,所以SiO2是两性氧化物
A、X可用作木材防火剂 B、步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+ Na2SO4 C、步骤Ⅱ中的稀硫酸可用CO2来代替 D、SiO2既能与盐酸反应,又能与氢氟酸反应,所以SiO2是两性氧化物二、填空题
-
11. 现代化城市建设离不开各种材料。(1)、水泥具有性和强吸水性;水泥砂浆是、和水的混合物,是建筑用黏合剂;混凝土是、和的混合物,用钢筋做结构的混凝土强度很大。(2)、玻璃生产的主要原料是、和。12. 黏土是很多硅酸盐产品的原料之一,创造历史、享誉全球的景德镇陶瓷就是利用了当地的优质黏土资源.请回答下列问题:(1)、黏土主要有效成分的化学式为Al2Si2O5(OH)4 , 若以氧化物形式表示,应写为 .(2)、在黏土资源丰富的地区还可以兴建水泥厂、玻璃厂、硫酸厂等,这些工厂中属于硅酸盐工业的有 , 玻璃厂生产雕花玻璃过程所依据的化学原理是(用化学方程式表示).13. 高纯度的单晶硅生产方法主要为:
SiO2 粗硅 Si(纯) 单晶硅
制得的粗硅中含有的杂质主要为(写化学式)
请分别写出上述流程中①、③的化学方程式:①③ .
三、实验探究题
-
14.(1)、工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式。工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg + Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
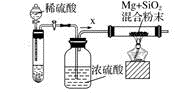 (2)、由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用(填序号)。
(2)、由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用(填序号)。a.石灰石
b.锌粒
c.纯碱
(3)、实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ;当反应引发后,移走酒精灯,反应能继续进行,其原因是。(4)、反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应① , ②。15.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HClSiHCl3+H2
③SiHCl3与过量H2在1100℃反应制得纯硅,已知SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
(1)、第①步制备粗硅的化学反应方程式为(2)、粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点﹣84.7℃),提纯SiHCl3采用的方法为(3)、用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
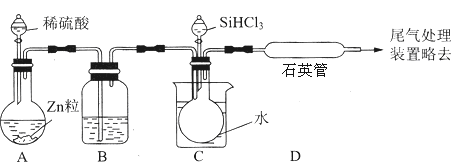
①装置B中的试剂是 .装置C中的烧瓶需要加热,其目的是 .
②反应一段时间后,装置D中观察到的现象是 ,装置D中发生反应的化学方程式为 .
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 .
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
四、综合题
-
16. 中国高铁对实现“一带一路”的战略构想有重要的作用。(1)、建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和;(2)、高铁上的信息传输系统使用了光导纤维,其主要成分是;乘务员使用的无线通话机的芯片材料是。(3)、高铁上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为。(4)、高铁上的卫生间没有任何异味,是由于所使用的马桶,地漏和洗手盆下水口都是纳米硅胶的高科技产品, 向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式为。17.
如图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是有B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白:
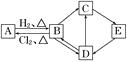 (1)、A、D、E的化学式分别为、、。(2)、A和B的互相转化在工业上有什么实际意义?
(1)、A、D、E的化学式分别为、、。(2)、A和B的互相转化在工业上有什么实际意义?。
(3)、写出D→C反应的化学方程式:。
(4)、写出E→D反应的化学方程式:。18. A 元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料一一光导纤维,C 与烧碱反应生成含A 元素的化合物D。(1)、写出C与氢氟酸发生反应的化学方程式是(2)、将C与纯碱混合高温熔融时反应生成D,同时还生成氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。①分别写出生成D和F的化学方程式:、。
②要将NaOH高温熔化,下列坩埚中可选用的是。
a.普通玻璃坩埚
b.石英玻璃坩埚
c.氧化铝坩埚
d.铁坩埚
(3)、碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L。生成氢气的离子方程式为 , 硅酸盐的物质的量浓度为mol/L。(4)、下列叙述正确的有(填序号)。①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2