华师大版初中科学九年级上学期 第3章 金属与盐 单元试卷
试卷更新日期:2020-08-26 类型:单元试卷
一、选择题(每题3分,共45分)
-
1. “垃圾是放错了位置的资源”,应该分类回收。生活中废弃的铁锅、铝制的易拉罐、铜导线等都可以归为一类加以回收。它们属于( )A、化合物 B、非金属 C、金属或合金 D、金属2. 硫酸的工业用途广泛,如生产染料、农药、化学纤维、塑料等。实验室可以用稀硫酸来制取H2S气体:FeS+H2SO4=FeSO4+H2S↑,该反应属于( )A、分解反应 B、化合反应 C、置换反应 D、复分解反应3. 铁制品在通常情况下很容易生锈,制造时往往在铁制品表面电镀一层铜起防锈作用。下列说法正确的是( )A、镀铜铁制品不可以在弱酸性条件下使用 B、镀铜铁制容器可盛硝酸银溶液 C、镀铜铁制品不易生锈的原因之一是使铁隔绝了空气 D、镀铜铁制品是一种合金4. 下列说法符合图中漫画情景的是( )
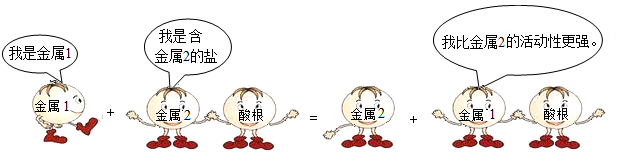 A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液5. 某品牌爽肤水为蓝色溶液,小明怀疑其含有硫酸铜,欲通过检测硫酸根离子进行初步判断,应选用的试剂是( )A、Ba(NO3)2溶液和稀HNO3 B、紫色石蕊试液 C、NaOH溶液 D、NaCl溶液和稀HNO36. 若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )A、Mn+H2SO4=MnSO4+H2↑ B、Mg+MnSO4=MgSO4+Mn C、Fe+MnSO4=FeSO4+Mn D、Mn+CuSO4=MnSO4+Cu7. “愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )
A、此反应可能是复分解反应 B、若金属1是锌,金属2可能是银 C、此反应可能是Cu+2AgCl=2Ag+CuCl2 D、比较铁和铜的活动性强弱可以用硫酸镁溶液5. 某品牌爽肤水为蓝色溶液,小明怀疑其含有硫酸铜,欲通过检测硫酸根离子进行初步判断,应选用的试剂是( )A、Ba(NO3)2溶液和稀HNO3 B、紫色石蕊试液 C、NaOH溶液 D、NaCl溶液和稀HNO36. 若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )A、Mn+H2SO4=MnSO4+H2↑ B、Mg+MnSO4=MgSO4+Mn C、Fe+MnSO4=FeSO4+Mn D、Mn+CuSO4=MnSO4+Cu7. “愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )①比较硬度,硬度小的是“愚人金”
②灼烧 ,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡产生的是“愚人金”
④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A、①③ B、②④ C、①④ D、②③8. 生活中常有发生亚硝酸钠中毒事件的报道,这是因为亚硝酸钠外观酷似食盐且有咸味。工业用盐中常混有亚硝酸钠,有关氯化钠和亚硝酸钠的部分资料见表。如要检验食盐中有无亚硝酸钠,下列判定方法错误的是( )化学式
水溶性
酸碱性
热稳定性
和稀盐酸作用
NaNO2
100℃时的溶解度为163g
弱碱性
320℃以上会分解,放出带刺激性气味的气体
放出红棕色气体
NaCl
100℃时的溶解度为39.12g
中性
受热不分解
不反应
A、在食盐中加入盐酸,观察有无红棕色气体放出 B、蒸干100g100℃食盐饱和溶液,称量溶质的质量是不是39.12g C、用pH试纸测定食盐溶液的酸碱性 D、把食盐加热到320℃以上观察有无带刺激性气味的气体放出9. 下列各组物质的溶液,根据它们自身的性质和相互间的反应现象,不用其他试剂就可以加以鉴别的是( )A、FeCl3 NaCl Ba(OH)2 B、KCl HCl NaNO3 C、Na2SO4 HCl H2SO4 D、CuCl2 NaNO3 K2SO410. 下列除杂质的方法错误的是( )选项
物质(括号内为杂质)
除杂方法
A
NaCl(泥沙)
溶解、过滤、蒸发
B
FeCl2(CuCl2)
加入适量铁粉,过滤
C
CaCl2溶液(盐酸)
加入过量CaCO3 , 过滤
D
CO2(CO)
通入澄清石灰水
A、A B、B C、C D、D11. 用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应。产生氢气的质量和反应所用时间的关系如图所示。则下列说法不正确的是( )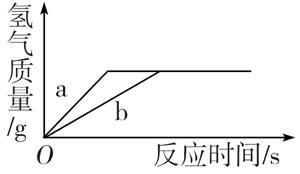 A、曲线a、b分别表示锌、铁的反应情况 B、盐酸均反应完,锌、铁可能均有剩余 C、盐酸均反应完,锌可能恰好完全反应,铁有剩余 D、锌、铁都反应完,盐酸有剩余12. 有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是( )A、0.2g B、0.6g C、0.8g D、0.9g13. 把A、B两块质量相等的铁片分别放进盛有等质量、等质量分数的盐酸和硫酸的两个烧杯中,两烧杯分别放在一天平的左右两个托盘上。充分反应后铁片都有剩余,则天平指针( )A、偏向盐酸一边 B、偏向硫酸一边 C、无法判断 D、天平平衡14. 钛和钛合金是重要的金属材料。工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:①2FeTiO3+6C+7Cl2=2TiCl4+2FeCl3+6CO;②在氩气环境中:2Mg+TiCl4 Ti+2MgCl2。已知Ti的相对原子质量为48,下列判断不正确的是( )A、反应①中生成的气体对环境有污染 B、反应②中氯化物的总质量保持不变 C、反应①、②中钛元素的化合价都改变 D、反应②中氩气作为保护气不参加反应15. 下列说法不正确的有( )
A、曲线a、b分别表示锌、铁的反应情况 B、盐酸均反应完,锌、铁可能均有剩余 C、盐酸均反应完,锌可能恰好完全反应,铁有剩余 D、锌、铁都反应完,盐酸有剩余12. 有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是( )A、0.2g B、0.6g C、0.8g D、0.9g13. 把A、B两块质量相等的铁片分别放进盛有等质量、等质量分数的盐酸和硫酸的两个烧杯中,两烧杯分别放在一天平的左右两个托盘上。充分反应后铁片都有剩余,则天平指针( )A、偏向盐酸一边 B、偏向硫酸一边 C、无法判断 D、天平平衡14. 钛和钛合金是重要的金属材料。工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:①2FeTiO3+6C+7Cl2=2TiCl4+2FeCl3+6CO;②在氩气环境中:2Mg+TiCl4 Ti+2MgCl2。已知Ti的相对原子质量为48,下列判断不正确的是( )A、反应①中生成的气体对环境有污染 B、反应②中氯化物的总质量保持不变 C、反应①、②中钛元素的化合价都改变 D、反应②中氩气作为保护气不参加反应15. 下列说法不正确的有( )①除去二氧化碳中混有的少量氧气,可以通入一氧化碳后点燃,将氧气转化为二氧化碳;
②实验室用6%的氯化钠溶液配制3%的氯化钠溶液,量取6%的氯化钠溶液时俯视读数,若其他操作均正确,则所配溶液中溶质的质量分数大于3%;
③某固体可能由氯化钠、硫酸钠、氯化钡、氯化镁、硫酸钾中的一种或几种组成,取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解,则该固体的组成有5种情况;
④某碳酸钠溶液中可能含有另一种溶质,取一定量该溶液,逐滴滴加稀盐酸,产生气体的体积与加入稀盐酸的体积关系如图所示,则该碳酸钠溶液中一定含有氢氧化钠。
 A、1种 B、2种 C、3种 D、4种
A、1种 B、2种 C、3种 D、4种二、填空题(每空2分,共28分)
-
16. 某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。(已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
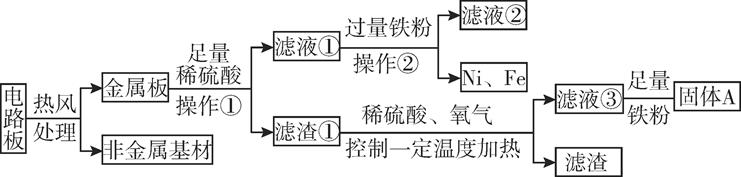 (1)、操作①的名称是 , 写出滤液②中金属阳离子符号:。(2)、写出滤液③和铁粉发生反应的一个化学方程式:。(3)、写出固体A的成分: , Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是。(4)、回收过程中需要过量铁粉,滤液①中加入过量铁粉的目的是 , 工业上高炉炼铁的原理是(用化学方程式表示) , 铁锭可以轧成铁板,体现了金属的性。17. 某科学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(1)、操作①的名称是 , 写出滤液②中金属阳离子符号:。(2)、写出滤液③和铁粉发生反应的一个化学方程式:。(3)、写出固体A的成分: , Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是。(4)、回收过程中需要过量铁粉,滤液①中加入过量铁粉的目的是 , 工业上高炉炼铁的原理是(用化学方程式表示) , 铁锭可以轧成铁板,体现了金属的性。17. 某科学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。【查阅资料】硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
【实验与探究】
内容
现象
实验解析
结论
实验一

化学方程式是:K2CO3+H2SO4=K2SO4+H2O+CO2↑
生成物中有气体或有或有沉淀生成时,复分解反应可以发生
实验二

溶液颜色由红色恰好变为无色

实验三

产生白色沉淀
该反应的实质是:Ba2++ =BaSO4↓
实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是。
【拓展与应用】将稀盐酸、Ca(OH)2溶液、NaCl溶液和Na2CO3溶液任意两种溶液相混合,写出能发生反应且有沉淀生成的化学方程式:。
三、实验探究题(每空2分,共30分)
-
18. “一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素”,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。
【查阅资料】钠常温下就能与水发生剧烈反应,反应的化学方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表中所示。
实验编号
钠块大小
硫酸铜溶液
实验中产生沉淀的现象
①
绿豆大小
稀溶液10mL
产生蓝绿色沉淀
②
绿豆大小
浓溶液10mL
产生蓝色絮状沉淀
③
豌豆大小
稀溶液10mL
产生蓝色絮状沉淀
④
豌豆大小
浓溶液10mL
产生蓝色絮状沉淀,并出现黑色固体
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
【实验结论】
(1)、上述实验中均未观察到色固体生成,由此判断猜想一错误。(2)、实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。【实验反思】实验中生成氢氧化铜沉淀的原理是。
(3)、由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。(4)、为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由:。
19. 碳酸氢钠(NaHCO3)是一种重要的盐类物质,在生活中用途广泛。小洪同学设计实验对碳酸氢钠的性质进行了探究,请你参与她的探究活动。(1)、【探究实验1】碳酸氢钠溶液的酸碱性。【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。
结论:碳酸氢钠溶液呈性。
(2)、【探究实验2】碳酸氢钠的热稳定性。【实验方案】设计实验装置如图,并进行实验。

现象:试管口有水珠,澄清石灰水变浑浊。充分加热后,试管中有白色固体剩余。
结论:碳酸氢钠受热有、水和白色固体生成。
试管①中反应的化学方程式为。
小洪的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3或的混合物。
Ⅰ.他的依据是。
Ⅱ.小洪的同学为了确定反应后的固体产物成分,进行以下实验,请填写表格:
实验
实验现象
结论
实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液
溶液变成红色
固体产物一定是NaOH
实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液
固体产物含有Na2CO3
实验三:取实验二所得的上层清液于试管中,滴加
固体产物是Na2CO3 , 而不是NaOH
【讨论与评价】实验一的结论与实验二的结论相反,在讨论时,小洪认为实验一的结论不正确,她的理由是。试写出碳酸氢钠受热发生反应的化学方程式:。
【拓展与应用】根据以上探究,请说出碳酸氢钠在日常生活中的一种用途:。
四、解答题(20题4分,21题6分,22题7分,共17分)
-
20. 把光亮的铁丝插入到质量分数为10%的足量硫酸铜溶液中,一段时间后:(1)、观察到的现象是。(2)、如有5.6g铁丝反应完全,需消耗多少克硫酸铜溶液?21. 实验室中发现一瓶因长期放置而被氧化的铝粉。取6.0g铝粉样品,将100g稀硫酸逐滴加入其中,固体质量随加入硫酸溶液质量的变化情况如图所示,实验过程中测得产生氢气0.1g。请计算:
 (1)、样品中铝单质的质量。(写出计算过程)(2)、硫酸溶液的溶质质量分数为。22. 我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。小伟同学取该湖盐样品进行探究。
(1)、样品中铝单质的质量。(写出计算过程)(2)、硫酸溶液的溶质质量分数为。22. 我国西北地区有很多咸水湖,其中最大的是柴达木盆地的察尔汗盐池。某盐湖附近的农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。小伟同学取该湖盐样品进行探究。【提出问题】该湖盐样品的成分是什么?
【查阅资料】冬天捞碱的“碱”指Na2CO3 , 夏天晒盐的“盐”指NaCl。
【猜想与假设】猜想一:Na2CO3;
猜想二:NaCl;
猜想三:Na2CO3和NaCl。
(1)、【实验探究】实验
实验操作
实验现象
实验结论
实验一
取少量样品于试管中,加适量水溶解后,加入过量稀HNO3
产生能使澄清石灰水变浑浊的气体
①猜想不成立
实验二
②向实验一所得的溶液中加入适量的
③
猜想三成立
(2)、【拓展延伸】为进一步确定该湖盐样品中Na2CO3的质量分数,小伟同学再取该湖盐样品10.00g做了如图所示的补充实验。
反应结束之后通入空气的目的是。
(3)、装置A中浓NaOH溶液的作用是(用化学方程式表示)。(4)、实验结束后测得装置D增重0.44g,则湖盐样品中Na2CO3的质量分数为多少?