陕西省咸阳市武功县2019-2020学年高三上学期化学第一次月考试卷
试卷更新日期:2020-08-26 类型:月考试卷
一、单选题
-
1. 化学与生活密切相关。下列叙述错误的是( )A、高纯硅可用于制作光感电池 B、铝合金大量用于高铁建设 C、活性炭具有除异味和杀菌作用 D、冬季燃煤中掺石灰可降低SO2排放2. 下列化学用语表达正确的是( )A、含78个中子的碘原子: B、Cl-的结构示意图:
 C、CaCl2的电子式:
C、CaCl2的电子式: 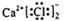 D、乙烯的结构简式:C2H4
3. 下列物质分类正确的是( )A、墨水、蛋白质溶液均属于胶体 B、H2O、CO2均为电解质 C、NO、SO3均为酸性氧化物 D、H2S、O2常作还原剂4. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,30g乙烷中所含的共价键数为6NA B、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA C、0.1mol D2O分子中含中子数为1.0NA D、0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA5. 下列解释事实的方程式正确的是( )A、用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O B、氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3 C、向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓ D、氯气用于自来水消毒:Cl2 + H2O 2H+ + Cl-+ ClO-6. 在给定条件下,能顺利实现下列所示物质间直接转化的是( )A、 B、 C、 D、7. 以CO2和Na2O2为原料,制取纯净干燥的O2 , 实验装置如下:
D、乙烯的结构简式:C2H4
3. 下列物质分类正确的是( )A、墨水、蛋白质溶液均属于胶体 B、H2O、CO2均为电解质 C、NO、SO3均为酸性氧化物 D、H2S、O2常作还原剂4. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,30g乙烷中所含的共价键数为6NA B、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA C、0.1mol D2O分子中含中子数为1.0NA D、0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA5. 下列解释事实的方程式正确的是( )A、用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O B、氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3 C、向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓ D、氯气用于自来水消毒:Cl2 + H2O 2H+ + Cl-+ ClO-6. 在给定条件下,能顺利实现下列所示物质间直接转化的是( )A、 B、 C、 D、7. 以CO2和Na2O2为原料,制取纯净干燥的O2 , 实验装置如下:
下列说法错误的是( )
A、装置②中试剂可以是NaOH溶液 B、装置③的作用是干燥O2 C、收集氧气应选择装置a D、装置②、③之间应增加盛澄清石灰水的洗气瓶8. 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,错误的是( ) A、氧化性的强弱顺序为:Cl2>IO3->I2 B、途径Ⅱ中若生成1mol I2 , 消耗4mol NaHSO3 C、一定条件下,I-与IO3-反应可能生成I2 D、向含I-的溶液中通入Cl2 , 所得溶液加入淀粉溶液不一定变为蓝色9. 四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述正确的是( )A、b元素最高价氧化物对应的水化物为强酸 B、最简单气态氢化物的热稳定性:b>c C、c为第二周期第VIIA族元素 D、原子半径:d>c>b>a10. 1mol白磷(P4 , s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
A、氧化性的强弱顺序为:Cl2>IO3->I2 B、途径Ⅱ中若生成1mol I2 , 消耗4mol NaHSO3 C、一定条件下,I-与IO3-反应可能生成I2 D、向含I-的溶液中通入Cl2 , 所得溶液加入淀粉溶液不一定变为蓝色9. 四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述正确的是( )A、b元素最高价氧化物对应的水化物为强酸 B、最简单气态氢化物的热稳定性:b>c C、c为第二周期第VIIA族元素 D、原子半径:d>c>b>a10. 1mol白磷(P4 , s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( ) A、P4(s,白磷)=4P(s,红磷) ΔH>0 B、以上变化中,白磷和红磷所需活化能相等 C、白磷比红磷稳定 D、红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol11. 在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2 , 下列说法错误的是( )
A、P4(s,白磷)=4P(s,红磷) ΔH>0 B、以上变化中,白磷和红磷所需活化能相等 C、白磷比红磷稳定 D、红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol11. 在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2 , 下列说法错误的是( ) A、在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2 B、在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点 C、图中a点对应的是AgBr的不饱和溶液 D、在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈81612. 以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
A、在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2 B、在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点 C、图中a点对应的是AgBr的不饱和溶液 D、在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈81612. 以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
上述装置工作时,下列有关说法正确的是( )
A、乙池电极接电池正极,气体X为H2 B、Na+由乙池穿过交换膜进入甲池 C、NaOH溶液Z比NaOH溶液Y浓度小 D、甲池电极反应:4OH--4e-=2H2O+O2↑13. 关于化合物2-苯基丙烯( ),下列说法错误的是( ) A、能使酸性高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、易溶于苯难溶于水 D、分子中所有碳原子一定共平面14. 下列实验现象与实验操作不相匹配的是( )
),下列说法错误的是( ) A、能使酸性高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、易溶于苯难溶于水 D、分子中所有碳原子一定共平面14. 下列实验现象与实验操作不相匹配的是( )实验操作
实验现象
A
向盛有FeCl3溶液的试管中加过量铁粉,充分震荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
B
向硫酸铝溶液中滴加氨水至过量
产生白色沉淀,且不消失
C
向盛有溴的四氯化碳溶液的试管中通入足够的乙烯后静置
溶液的红棕色逐渐褪去,静置后溶液分层
D
向盛有饱和硫代硫酸钠溶液的试管中滴加稀硫酸
有刺激性气味气体产生,溶液变浑浊
A、A B、B C、C D、D二、实验题
-
15. 产自我国西北某盐湖的“块碱”是一种Na2CO3和NaCl的混合物。可通过以下方法对块碱样品的组成和含量进行分析测定。(1)、I.定性测定NaCl的存在:
取样品少许溶于水,加入足量稀硝酸充分反应后再滴加溶液,能观察到有产生,说明块碱中含有NaCl。
(2)、II.定量测定Na2CO3的含量:准确称量w g样品置于如图所示的装置中,向其中加入足量稀硫酸,通过测定生成气体的体积来求算Na2CO3的含量。请回答下列相关问题:
测定装置中,导管a的作用是。
(3)、为提高测定的准确度,溶液b最宜选用。①饱和食盐水 ②饱和NaHCO3溶液 ③澄清石灰水 ④酸性KMnO4溶液
(4)、以下是测量收集到气体体积必须包括的几个步骤:①调整橡胶管所连两装置液面高度使之相同;②使装置内的气体都冷却至室温;③读取碱式滴定管的示数。这三步操作的正确顺序是:(请填写步骤代号)。三、工业流程
-
16. 以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:

已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m
PH
开始沉淀
沉淀完全
Fe (OH)3
2.53
2.94
Ni(OH)2
7.60
9.75
(1)、K2FeO4中铁元素的化合价为。(2)、“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是(用离子方程式表示)。(3)、步骤③发生反应的离子方程式为。(4)、步骤⑤是将Fe(OH)3固体氧化为Na2FeO4 , 同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为g;步骤④调节pH的范围是。(5)、用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2 , 滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。①滴定时选用的指示剂为 , 滴定终点的现象为。
②粗K2FeO4的纯度为。
四、综合题
-
17. 化学反应有物质的变化过程中还有能量的转化,据此回答下列问题:(1)、已知甲醇的燃烧热为725.8kJ·mol-1 , 写出表示其燃烧热的热化学方程式:。(2)、已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI (g)分子中化学键断裂时需吸收的能量为kJ。(3)、已知:CO(g)+2H2(g) →CH3OH(g)△H1=-90.1 kJ·mol-1;3CH3OH(g) CH3CH=CH2(g)+H2O(g) △H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为。(4)、甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池。其工作原理示意如图:

则其负极反应式为。
18. 二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:实验编号
时间/min
60
90
120
150
180
Ⅰ
T1/K
1.50mol
1.32 mol
1.28 mol
1.26 mol
1.26 mol
Ⅱ
T2/K
1.45mol
1.20 mol
1.10 mol
1.10 mol
1.10 mol
(1)、实验I中0~60min内用HCOOH表示的该反应的平均反应速率为。(2)、实验II反应开始时体系压强为P0 , 第90min时体系压强为P1 , 则P1:P0=。(3)、T2温度下反应的平衡常数为。(4)、比较实验温度T1T2(填“>”或“<”),该反应的△H0(填“>”、“=”或“<”)。(5)、下列说法正确的是_______(填编号)。A、当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡 B、容器中气体密度不再改变,不能判断该反应是否达到平衡 C、将HCOOH液化后分离既能提高转化率又能加快反应速率 D、选用更高效的催化剂可提高生产效率五、填空题
-
19. 25℃时,pH均为5的①HCl溶液、②CH3OOOH溶液和③NH4Cl溶液。回答下列问题:(1)、③溶液中c(OH-)·c(H+)=。(2)、①和②溶液加水稀释相同倍数后pH:①②(填“>”、“=”或“<”,下同);取相同体积的①和②溶液用NaOH中和,消耗NaOH的物质的量:①②。(3)、三溶液中水的电离程度由大到小的顺序为。(4)、③溶液中,下列关系式错误的是_______________A、c(NH4+)+c(H+)=c(Cl-)+c(OH-) B、(NH4+)+c(NH3·H2O)=c(Cl-) C、c(NH3·H2O)+c(OH-)=c(H+) D、c(Cl-)>c(NH4+)>c(OH-)>c(H+)
六、推断题
-
20. 合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式如下: CH3COO[Cu(NH3)2]+CO+NH3=CH3COO[Cu(NH3)3CO]。(1)、Cu+基态核外电子排布式为。(2)、C、N、O元素的第一电离能由大到小的顺序为。(3)、1mol[Cu(NH3)2]+中含有σ键的数目为 , CH3COO[Cu(NH3)2]中C原子轨道的杂化类型是。(4)、与NH3分子互为等电子体的阴离子为。(5)、Cu2O的晶胞结构如图所示,其中O2-的配位数是。
 21. 化合物F是一种食品保鲜剂,可按如下途径合成:
21. 化合物F是一种食品保鲜剂,可按如下途径合成:
已知: 。试回答:
(1)、A的化学名称是 , A→B的反应类型是。(2)、B→C反应的化学方程式为。(3)、C→D所用试剂和反应条件分别是。(4)、E的结构简式是。F中官能团的名称是。(5)、连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有种。其中苯环上只有一个取代基,核磁共振氢谱有5个峰,峰面积比为2:1:2:2:1的同分异构体的结构简式为(写出一种即可)。
-
-
-