陕西省渭南韩城市2019-2020学年高三上学期化学第二次月考试卷
试卷更新日期:2020-08-26 类型:月考试卷
一、单选题
-
1. 关于下列诗句或谚语,说法错误的是( )A、“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 B、“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 C、“滴水石穿、绳锯木断”不包含化学变化 D、“落汤螃蟹着红袍”肯定发生了化学变化2. 下列化学用语表述正确的是( )A、核内质子数为117、中子数为174的核素Ts可表示为: B、氯离子的结构示意图:
 C、COCl2的结构式为:
C、COCl2的结构式为: 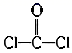 D、CaO2的电子式为:
D、CaO2的电子式为:  3. 下列装置能达到实验目的的是( )
3. 下列装置能达到实验目的的是( )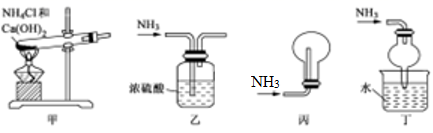 A、用装置甲制备氨气 B、用装置乙除去氨气中少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气4. 一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
A、用装置甲制备氨气 B、用装置乙除去氨气中少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气4. 一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( ) A、气球B中装的是O2 B、气球A和气球D中气体物质的量之比为4:1 C、气球A和气球C中气体分子数相等 D、气球C和气球D中气体密度之比为2:15. 用硫酸铜晶体配制 480mL 浓度为 0.5mol/L的溶液,下列说法正确的是( )A、用托盘天平称量60.0g硫酸铜晶体 B、如果称量时药品和砝码放反了,对配制结果没有影响,因为没有使用游码 C、如果定容时俯视所配溶液浓度会偏高 D、在转移溶液后,可以不用洗涤玻璃棒6. 为检验某种钠盐溶液中含有的阴离子是SO42-、CO32-还是OH-、Cl- , 下面设计的方案中合理的是( )A、检验CO32-:向待测液中加入足量的盐酸产生气泡,将气体通入浓Ba(OH)2溶液有白色沉淀生成 B、检验SO42-:向待测液中加入盐酸至酸性,未见沉淀或气体生成,再加入BaCl2溶液出现白色沉淀 C、检验OH-:向待测液中加入石蕊溶液,溶液变红色 D、检验Cl-:向待测液中加入AgNO3溶液和稀盐酸的混合液,有白色浑浊物出现7. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A、气球B中装的是O2 B、气球A和气球D中气体物质的量之比为4:1 C、气球A和气球C中气体分子数相等 D、气球C和气球D中气体密度之比为2:15. 用硫酸铜晶体配制 480mL 浓度为 0.5mol/L的溶液,下列说法正确的是( )A、用托盘天平称量60.0g硫酸铜晶体 B、如果称量时药品和砝码放反了,对配制结果没有影响,因为没有使用游码 C、如果定容时俯视所配溶液浓度会偏高 D、在转移溶液后,可以不用洗涤玻璃棒6. 为检验某种钠盐溶液中含有的阴离子是SO42-、CO32-还是OH-、Cl- , 下面设计的方案中合理的是( )A、检验CO32-:向待测液中加入足量的盐酸产生气泡,将气体通入浓Ba(OH)2溶液有白色沉淀生成 B、检验SO42-:向待测液中加入盐酸至酸性,未见沉淀或气体生成,再加入BaCl2溶液出现白色沉淀 C、检验OH-:向待测液中加入石蕊溶液,溶液变红色 D、检验Cl-:向待测液中加入AgNO3溶液和稀盐酸的混合液,有白色浑浊物出现7. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )①22gT2O含有电子数为10NA
②0.44gC3H8中含有的共价键总数目为0.1NA
③1molNa2O2与CO2完全反应时转移电子数为2NA
④28g硅晶体中含有2NA个Si—Si键
⑤11.2LCl2通入足量的NaOH溶液中充分反应,转移的电子数等于0.5NA
⑥200mL1mol·L-1Al2(SO4)3溶液中Al3+和SO42-的数目总和是NA
A、①②③ B、②④⑥ C、①③⑤ D、①②④8. 硅及其化合物是带来人类文明的重要物质。下列说法正确的是( )A、陶瓷、水晶、水泥、玻璃都属于硅酸盐 B、水玻璃是纯净物,可用于生产黏合剂和防火剂 C、某硅酸盐的化学式为KAlSi3O8 , 可用K2O·Al2O3·6SiO2表示 D、高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池9. 下列表示对应化学反应的离子方程式正确的是( )A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O B、明矾溶于水产生Al(OH)3胶体:Al3++3H2O =Al(OH)3↓+3H+ C、Na2O2溶于水产生O2:Na2O2+H2O =2Na++2OH-+O2↑ D、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O10. 在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl- , 在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( ) A、在上述反应体系中,CNO-是氧化剂 B、还原产物与氧化产物的物质的量之比为1∶3 C、在标准状况下,产生4.48 L N2时转移0.8 mol电子 D、上述反应中,只有两种元素化合价发生了变化11. 将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )A、标准状况下,反应过程中得到7.84 L的气体 B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) C、最终得到7.8 g的沉淀 D、最终得到的溶液中c(Na+)=1.5 mol·L-112. 某无色稀溶液X中,可能含有下表所列离子中的某几种。
A、在上述反应体系中,CNO-是氧化剂 B、还原产物与氧化产物的物质的量之比为1∶3 C、在标准状况下,产生4.48 L N2时转移0.8 mol电子 D、上述反应中,只有两种元素化合价发生了变化11. 将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )A、标准状况下,反应过程中得到7.84 L的气体 B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) C、最终得到7.8 g的沉淀 D、最终得到的溶液中c(Na+)=1.5 mol·L-112. 某无色稀溶液X中,可能含有下表所列离子中的某几种。阴离子
CO
 、SiO32-、[Al(OH)4]-、Cl-
、SiO32-、[Al(OH)4]-、Cl-阳离子
Al3+、Fe3+、Mg2+、NH4+、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
 A、若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]- B、若Y是盐酸,则溶液中可能含有的阳离子是Al3+ C、若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- D、若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-13. 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
A、若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]- B、若Y是盐酸,则溶液中可能含有的阳离子是Al3+ C、若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- D、若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-13. 下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( ) A、元素的非金属性: X>R>W B、简单离子的半径:W>R>X C、X与W形成的化合物中只有共价键 D、X与Z形成的化合物中只有离子键14. CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是( )
A、元素的非金属性: X>R>W B、简单离子的半径:W>R>X C、X与W形成的化合物中只有共价键 D、X与Z形成的化合物中只有离子键14. CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是( ) A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3 B、利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol C、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③ D、与途径①、③相比,途径②更好地体现了绿色化学思想15. 某同学设计了用氯气制取无水氯化铁(易升华)的相关装置,其中设计符合题意且能达到相应目的的是( )
A、途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3 B、利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol C、生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③ D、与途径①、③相比,途径②更好地体现了绿色化学思想15. 某同学设计了用氯气制取无水氯化铁(易升华)的相关装置,其中设计符合题意且能达到相应目的的是( ) A、用装置①制取氯气 B、用装置②除去Cl2中的HCl C、用装置③干燥氯气 D、用装置④制取并收集FeCl316. 铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )A、FeO·3Fe2O3 B、FeO·2Fe2O3 C、2FeO·3Fe2O3 D、2FeO·Fe2O317. 探究浓硫酸和铜的反应,下列装置或操作正确的是( )
A、用装置①制取氯气 B、用装置②除去Cl2中的HCl C、用装置③干燥氯气 D、用装置④制取并收集FeCl316. 铁的常见化合价有+2价和+3价。据研究,铁在浓HNO3中发生钝化时,可生成一种化学式为Fe8O11的化合物,它可以看作由FeO和Fe2O3组成的复杂氧化物。该化合物可以表示为( )A、FeO·3Fe2O3 B、FeO·2Fe2O3 C、2FeO·3Fe2O3 D、2FeO·Fe2O317. 探究浓硫酸和铜的反应,下列装置或操作正确的是( ) A、用装置甲进行铜和浓硫酸的反应 B、用装置乙收集二氧化硫并吸收尾气 C、用装置丙稀释反应后的混合液 D、用装置丁测定余酸的浓度18. 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是( )
A、用装置甲进行铜和浓硫酸的反应 B、用装置乙收集二氧化硫并吸收尾气 C、用装置丙稀释反应后的混合液 D、用装置丁测定余酸的浓度18. 短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是( )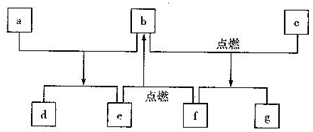 A、简单离子的半径:Y>Z>X B、元素的非金属性:W>X C、最高价氧化物对应水化物的碱性:Y>Z D、X、Y两种元素组成的化合物只含离子键
A、简单离子的半径:Y>Z>X B、元素的非金属性:W>X C、最高价氧化物对应水化物的碱性:Y>Z D、X、Y两种元素组成的化合物只含离子键二、解答题
-
19. X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X
Y
Z
M
R
Q
原子半径/nm
0.186
0.074
0.099
0.143
主要化合价
-4,+4
-2
-1,+7
+3
其他
阳离子核外无电子
无机非金属材料的主角
焰色反应呈黄色
(1)、R在元素周期表中的位置是;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为。(2)、Z的单质与水反应的化学方程式为。(3)、Y与R相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是 (填字母)。A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
(4)、根据表中数据推测,Y的原子半径(用r表示)的最小范围是。(5)、甲、乙是上述部分元素的最高价氧化物的水化物,且甲+乙→丙+水。若丙的水溶液呈碱性,则丙的化学式为。三、推断题
-
20.(1)、Ⅰ.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠。
在制备亚氯酸钠的反应中ClO2作(填“氧化剂”或“还原剂”);若反应中生成1 mol NaClO2 , 转移电子的物质的量为 。
(2)、该反应的化学方程式为。(3)、Ⅱ.有一瓶澄清的溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、[Al(OH)4]-。取该溶液进行以下实验:①用pH试纸检测,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:
a.溶液从酸性变为中性;
b.溶液中逐渐产生沉淀;
c.沉淀完全溶解;
d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
a.由①可以排除的存在。
b.由②可以证明的存在;同时排除的存在。
c.由③可以证明的存在。
d.由④可以排除SO42-的存在,同时证明Ba2+的存在。
e.写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c.;
d.。
四、实验题
-
21. 某学习小组在实验室中利用如图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

实验步骤:
步骤Ⅰ如图连接装置,检查装置气密性,装入试剂;
步骤Ⅱ旋开分液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤Ⅲ足够长时间后,D中产生气泡速率变快时,停止加热,继续向烧瓶中滴水一段时间
步骤Ⅳ实验结束后,将D中所得溶液加水配制成250mL溶液;
……
请回答:
(1)、步骤Ⅲ中,停止加热后还需继续向烧瓶中滴水一段时间,其目的为。(2)、在C、D装置之间不需要防倒吸装置的理由是。(3)、步骤Ⅳ中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有。(4)、取25.00mL步骤Ⅳ中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为。(5)、有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案是否合理:(填“是”或“否”),原因为。(6)、反应后D装置所得溶液中除含有Na2SO4外,还可能含有Na2SO3。现用滴定法测定溶液中Na2SO3的含量。可供选择的试剂:0.1000mol·L-1 KMnO4酸性溶液;0.1000mol·L-1 H2O2溶液;0.1000mol·L-1KI淀粉溶液;0.1000mol·L-1BaCl2溶液;0.1000mol·L-1HCl溶液。①所选试剂应装在(填“酸式”或“碱式”)滴定管中。
②所利用的反应原理为(用离子方程式表示)。
五、工业流程
-
22. 钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊接性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
 (1)、反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:。(2)、如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:。(3)、钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。(4)、工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2 , CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
(1)、反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:。(2)、如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:。(3)、钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。(4)、工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2 , CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
-
-
-