安徽省皖南八校2019-2020学年高三上学期化学第二次月考试卷
试卷更新日期:2020-08-26 类型:月考试卷
一、单选题
-
1. 化学与生活密切相关。下列叙述错误的是( )A、活性炭、漂白粉均具有杀菌作用 B、农作物秸秆可用于生产生物质燃料乙醇 C、大量燃烧化石燃料会引起大气中CO2含量上升 D、汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土2. 下列关于有机化合物的说法正确的是( )A、煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏得到 B、C4H8Cl2的同分异构体有9种(不含立体异构) C、苯乙烯(
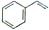 )分子中所有原子不可能共平面
D、乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
3. 下列实验方案能达到实验目的的是(部分加持装置已略去)( )A、
)分子中所有原子不可能共平面
D、乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
3. 下列实验方案能达到实验目的的是(部分加持装置已略去)( )A、 实验室制氨气
B、
实验室制氨气
B、 实验室制氢氧化亚铁
C、
实验室制氢氧化亚铁
C、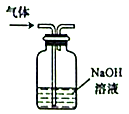 除去实验室所制乙烯中的少量SO2
D、
除去实验室所制乙烯中的少量SO2
D、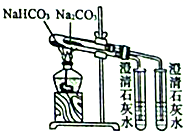 证明碳酸氢钠的热稳定性比碳酸钠弱
4. 已知NA是阿伏加德罗常数的值,下列说法错误的是( )A、常温下1LpH=2的H3PO4溶液中含有的H+数目为0.01NA B、0.1mol苯被氧化为CO2转移的电子数为3NA C、46.0g甘油(丙三醇)中共价键数目为6.5NA D、18g重水(D2O)中含有的中子数为10NA5. 用“KClO3氧化法”制备KIO3的工艺流程如下图所示,其中“酸化反应”所得到的产物有KH(IO3)2、Cl2和KCl。下列叙述错误的是( )
证明碳酸氢钠的热稳定性比碳酸钠弱
4. 已知NA是阿伏加德罗常数的值,下列说法错误的是( )A、常温下1LpH=2的H3PO4溶液中含有的H+数目为0.01NA B、0.1mol苯被氧化为CO2转移的电子数为3NA C、46.0g甘油(丙三醇)中共价键数目为6.5NA D、18g重水(D2O)中含有的中子数为10NA5. 用“KClO3氧化法”制备KIO3的工艺流程如下图所示,其中“酸化反应”所得到的产物有KH(IO3)2、Cl2和KCl。下列叙述错误的是( )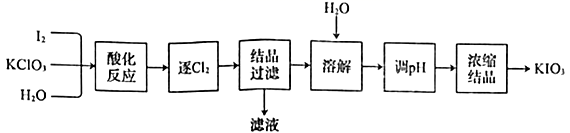 A、KIO3可作为食盐中的补碘剂 B、“逐Cl2”采用的方法通常是加热 C、“滤液”中的溶质主要是KCl D、“调pH”步骤中所加入的试剂是NaOH6. X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是( )A、简单氢化物的沸点:Y<Z B、化合物WY3中只存在离子键 C、原子半径:W>Z>Y>X D、X2Z与W2Z2发生的反应中,X2Z被氧化7. 常温下,向20mL0.10mol·L-1HClO溶液中逐滴加入0.10mol·L-1NaOH溶液,滴定过程中溶液中水电离出的c(H+)变化曲线如图所示。下列说法正确的是( )
A、KIO3可作为食盐中的补碘剂 B、“逐Cl2”采用的方法通常是加热 C、“滤液”中的溶质主要是KCl D、“调pH”步骤中所加入的试剂是NaOH6. X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是( )A、简单氢化物的沸点:Y<Z B、化合物WY3中只存在离子键 C、原子半径:W>Z>Y>X D、X2Z与W2Z2发生的反应中,X2Z被氧化7. 常温下,向20mL0.10mol·L-1HClO溶液中逐滴加入0.10mol·L-1NaOH溶液,滴定过程中溶液中水电离出的c(H+)变化曲线如图所示。下列说法正确的是( )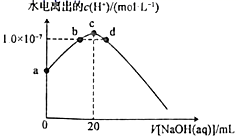 A、可用pH试纸测定a点溶液的pH B、b、c、d三点溶液中离子、分子种类不同 C、a、b、c、d四点溶液中水的电离程度:c>b=d>a D、d点溶液中c(Na+)=c(ClO-)
A、可用pH试纸测定a点溶液的pH B、b、c、d三点溶液中离子、分子种类不同 C、a、b、c、d四点溶液中水的电离程度:c>b=d>a D、d点溶液中c(Na+)=c(ClO-)二、工业流程
-
8. 锗是第四周期第ⅣA族元素,锗是重要的半导体材料,用于制造晶体管及各种电子装置。下图为以锗锌矿(含GeO2、ZnS及少量Fe2O3)为原料生产高纯度锗的工艺流程如下:
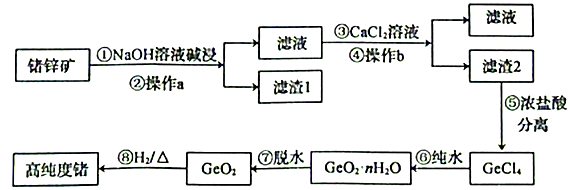
已知:GeO2可溶于强碱溶液,生成锗酸盐。GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)、步骤①中提高碱浸效率的措施有(写一种),NaOH溶液碱浸时发生反应的离子方程式为。(2)、操作a的名称是 , GeCl4的电子式为。(3)、滤渣1中除含有ZnS外,还含有少量。滤渣2中除含有 CaGeO3外,还含有少量。(4)、步骤⑤中加入浓盐酸,发生反应的化学方程式为。不用稀盐酸的原因是。(5)、写出一种证明步骤⑧反应完全的操作方法:。三、实验题
-
9. 硫代硫酸钠(Na2S2O3)可以除去自来水中的氯气,在水产养殖上被广泛应用。用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O的实验流程如下:
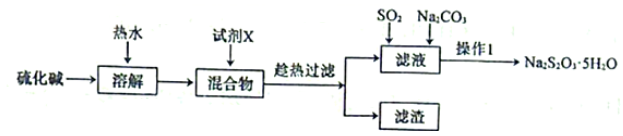
回答下列问题:
(1)、试剂X是一种二元化合物的钡盐,它与Na2SO4反应的化学方程式为。(2)、用热水溶解并趁热过滤的目的是。(3)、利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3 , 所需仪器如下图: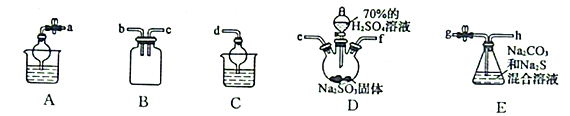
①从左到右连接各仪器,导管的接口顺序为:接e、f接、接、接d。
②E中发生反应的离子方程式为。
③装置B的作用是。
(4)、操作1包括蒸发浓缩、、、洗涤、干燥(5)、为测定产品Na2S2O3·5H2O的纯度,准确称取12.4gNa2S2O3·5H2O产品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示剂,用0.2500mol·L-1碘的标准溶液滴定,发生反应2S2O32-+I2= S4O62-+2I- , 消耗碘的标准溶液20.00mL,则该产品的纯度为。四、综合题
-
10. 环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:(1)、亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为。
相关化学键的键能如下表所示:
化学键
Cl—Cl
N≡O(NO气体)
Cl—N
N=O
键能/(kJ·mol-1)
243
630
200
607
(2)、为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO 2CO2+N2 , 平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示: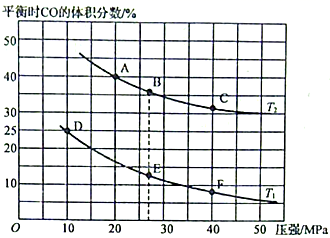
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的点(填标号)。
(3)、有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2 , 从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为。(4)、用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中 ,则该混合溶液的pH=(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2 , K a2=1.0×10-7)。(5)、电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下: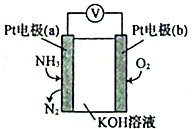
①电极b上发生的是反应(填“氧化”或“还原”)。
②电极a的电极反应为。
11. 物质的结构决定其性质,元素周期表和元素周期律揭示了化学元素间的内在联系,使其构成了一个完整的体系。回答下列问题:(1)、在硼、氮、氧、氟中,第一电离能由大到小排序为(用元素符号表示,下同)。四种元素中的基态原子中,未成对电子数最多的是。(2)、已知硼酸的电离方程式为H3BO3+H2O [B(OH)4]+H+。①硼酸是元酸。
②[B(OH)4]-中含有的化学键类型有(填标号)。
a.σ键 b.π键 c.配位键 d.非极性键
③由[B(OH)4]-推出[Al(OH)4]-的结构式为。
(3)、氟化硝酰(NO2F)与NO3-的结构相似,则其分子的立体构型是 , N原子的杂化轨道类型为。(4)、已知单质硼晶体的熔点为1873℃,单质硼晶体是晶体。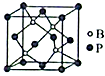 (5)、磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA , 则磷化硼晶体的密度为g·cm-3(列出计算式)。
(5)、磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA , 则磷化硼晶体的密度为g·cm-3(列出计算式)。五、推断题
-
12. 以芳香烃A为原料制备某重要医药中间体F的合成路线如下:
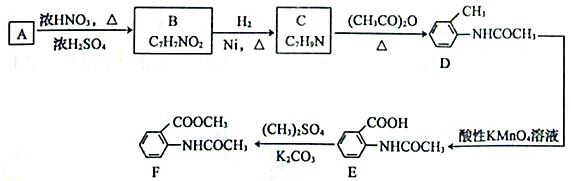
回答下列问题:
(1)、B的化学名称为。(2)、由A生成B的反应类型为 , 由D生成E的反应类型为。(3)、由C生成D的化学方程式为。(4)、已知E的同分异构满足下列条件:①遇FeCl3溶液呈紫色;
②苯环上的取代基不超过3个;
③1mol有机物与足量银氨溶液反应生成4 mol Ag;
④含有氨基(-NH2)。
这些同分异构体中的含氧官能团的名称是 , 这些同分异构体共有种(不考虑立体异构);其中核磁共振氢谱有五组峰,且峰面积比为2∶2∶2∶2∶1的结构简式为。
(5)、已知: 。
。 设计由
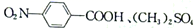 和CH3OH制备
和CH3OH制备  的合成路线:(无机试剂任选)。
的合成路线:(无机试剂任选)。
-
-