华师大版初中科学九年级上学期第1章 化学反应单元试卷
试卷更新日期:2020-08-24 类型:单元试卷
一、选择题(每题2分,共40分)
-
1. 甲和乙可以合成清洁燃料丙,微观过程如图所示。下列说法不正确的是( )
 A、丙物质中碳元素的质量分数最大 B、丙物质属于有机物,可用作溶剂和消毒剂 C、该反应中共有三种氧化物 D、该反应中参加反应的甲、乙两种物质的分子个数比为1∶22. 化学方程式书写正确的是( )A、C+O2=CO2 B、2C+O2 2CO C、Mg+O2 MgO2 D、S+O2 SO2↑3. 如图是“用双氧水制取收集一瓶氧气”实验的主要步骤,其中操作错误的是( )A、加入药品
A、丙物质中碳元素的质量分数最大 B、丙物质属于有机物,可用作溶剂和消毒剂 C、该反应中共有三种氧化物 D、该反应中参加反应的甲、乙两种物质的分子个数比为1∶22. 化学方程式书写正确的是( )A、C+O2=CO2 B、2C+O2 2CO C、Mg+O2 MgO2 D、S+O2 SO2↑3. 如图是“用双氧水制取收集一瓶氧气”实验的主要步骤,其中操作错误的是( )A、加入药品 B、收集气体
B、收集气体  C、检查装置气密性
C、检查装置气密性  D、验满
D、验满  4. 植物光合作用可表示为CO2+H2O 淀粉+O2 , 下列说法中正确的是( )A、淀粉中一定含C,H两种元素 B、淀粉中一定只含C,H两种元素 C、淀粉中可能含有三种以上的元素 D、淀粉可能是一种单质或一种化合物5. 磷在氧气中燃烧的化学反应可用“4P+5O2 2P2O5”来表示。以下信息:①反应条件;②反应速率;③反应物、生成物各物质间的质量关系;④反应的微观过程;⑤反应过程中的能量变化;⑥反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是( )A、①③④ B、②③⑤ C、①③⑥ D、②④⑥6. 下列变化,遵循质量守恒定律的是( )A、石墨制成金刚石 B、2gH2完全燃烧生成36gH2O C、水变成汽油 D、冰转化成干冰7. 下列反应中属于化合反应的是( )A、2Na+2H2O=2NaOH+H2↑ B、Fe2(SO4)3+Fe=3FeSO4 C、CaCO3 CaO+CO2↑ D、2NaCl+2H2O Cl2↑+H2↑+2NaOH8. 已知反应X+3O2 2CO2+2H2O,则X的化学式为( )A、C2H6 B、C2H4 C、C2H2 D、C2H6O9. 关于催化剂在化学反应中的作用说法正确的是( )A、一定加快反应速度 B、会减慢反应速度 C、加快或减慢反应速度 D、不改变反应速度10. 我国科学家成功实现首次单分子自旋态控制。这是世界上首次实现单个分子内部的化学反应。单个分子内部的化学反应中发生变化的是( )A、原子个数 B、原子种类 C、分子种类 D、元素种类11. 化学概念间有包含、并列、交叉等不同关系。下列选项符合如图所示关系的是( )
4. 植物光合作用可表示为CO2+H2O 淀粉+O2 , 下列说法中正确的是( )A、淀粉中一定含C,H两种元素 B、淀粉中一定只含C,H两种元素 C、淀粉中可能含有三种以上的元素 D、淀粉可能是一种单质或一种化合物5. 磷在氧气中燃烧的化学反应可用“4P+5O2 2P2O5”来表示。以下信息:①反应条件;②反应速率;③反应物、生成物各物质间的质量关系;④反应的微观过程;⑤反应过程中的能量变化;⑥反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是( )A、①③④ B、②③⑤ C、①③⑥ D、②④⑥6. 下列变化,遵循质量守恒定律的是( )A、石墨制成金刚石 B、2gH2完全燃烧生成36gH2O C、水变成汽油 D、冰转化成干冰7. 下列反应中属于化合反应的是( )A、2Na+2H2O=2NaOH+H2↑ B、Fe2(SO4)3+Fe=3FeSO4 C、CaCO3 CaO+CO2↑ D、2NaCl+2H2O Cl2↑+H2↑+2NaOH8. 已知反应X+3O2 2CO2+2H2O,则X的化学式为( )A、C2H6 B、C2H4 C、C2H2 D、C2H6O9. 关于催化剂在化学反应中的作用说法正确的是( )A、一定加快反应速度 B、会减慢反应速度 C、加快或减慢反应速度 D、不改变反应速度10. 我国科学家成功实现首次单分子自旋态控制。这是世界上首次实现单个分子内部的化学反应。单个分子内部的化学反应中发生变化的是( )A、原子个数 B、原子种类 C、分子种类 D、元素种类11. 化学概念间有包含、并列、交叉等不同关系。下列选项符合如图所示关系的是( )
选项
A
B
C
D
X
化合反应
纯净物
物理变化
化学反应
Y
氧化反应
混合物
化学变化
化合反应
A、A B、B C、C D、D12. 某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg。则c等于( )A、d+b+a B、d-b-a C、d-b+a D、d+b-a13. 乙醇(俗名酒精)是一种“绿色能源”,推广使用乙醇汽油有利于保护环境。乙醇完全燃烧的反应可表示为C2HxO+yO2 2CO2+3H2O,其中x、y的数值分别是( )A、6、3 B、6、6 C、5、7 D、3、314. 我国科学家屠呦呦因为“发现青蒿素(C15H22O5)——一种用于治疗疟疾的特效药”而获2015年诺贝尔生理学或医学奖。下列关于青蒿素的说法正确的是( )A、青蒿素是一种氧化物 B、青蒿素中氧元素的质量分数为11.9% C、青蒿素中C,H,O三种元素的质量比为90∶11∶40 D、青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的15. 在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如表中所示(已知甲、丙两种物质的式量比为1∶1),则下列说法正确的是( )四种物质
甲
乙
丙
丁
反应前质量/g
2
8
30
50
反应后质量/g
20
待测
39
23
A、该反应为化合反应 B、待测值为18 C、反应中丁和丙的质量比为3∶1 D、甲、丙两种物质化学计量数之比为1∶216. 在反应A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。又知D的式量为18,则A的式量为( )A、23 B、46 C、92 D、9617. 实验室常用加热高锰酸钾固体制取氧气,化学方程式为2KMnO4 K2MnO4+MnO2+O2↑。现对一定量的高锰酸钾固体进行加热,加热过程中涉及的相关量随时间变化的图像正确的是( )
A、 B、
B、 C、
C、 D、
D、 18. 下列性质:①颜色;②密度;③溶解性;④可燃性;⑤能否与水反应。其中实验室制取气体选择收集方法时,必须考虑的是( )A、①②③ B、②③④ C、③④⑤ D、②③⑤19. 将ag磷在bg氧气中燃烧,生成物的质量( )A、等于(a+b)g B、小于(a+b)g C、大于(a+b)g D、小于或等于(a+b)g20. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量见表。
18. 下列性质:①颜色;②密度;③溶解性;④可燃性;⑤能否与水反应。其中实验室制取气体选择收集方法时,必须考虑的是( )A、①②③ B、②③④ C、③④⑤ D、②③⑤19. 将ag磷在bg氧气中燃烧,生成物的质量( )A、等于(a+b)g B、小于(a+b)g C、大于(a+b)g D、小于或等于(a+b)g20. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量见表。物质
a
b
c
d
反应前的质量/g
40
40
10
32
反应后的质量/g
12
x
10
0
下列说法正确的是( )
A、x等于90 B、b可能是单质 C、c一定是催化剂 D、参加反应的a与d的质量比为7∶8二、填空题(每空2分,共28分)
-
21. 写出下列反应的化学方程式,并在括号内注明基本反应类型:(1)、铁丝在氧气中燃烧:()反应。(2)、实验室用氯酸钾和二氧化锰共热制取氧气:()反应。(3)、加热碳酸氢钙: ()反应。22. 用mg氯酸钾和ng二氧化锰的混合物制取氧气,当加热至固体质量不再减少时,冷却后称得残余固体的质量为pg。则生成氧气的质量为g(用所给的字母表示)。23. 某化学反应的化学方程式为aC2H6+bO2 mCO2+nH2O,则a和n之间的关系式为。24. 碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为;充分加热24g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3∶4,则该反应生成水和二氧化碳的质量之和为g。25. 小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图(提示:CaCO3+2HCl=CaCl2+H2O+CO2↑)。
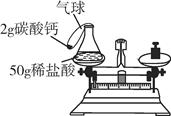 (1)、根据实验目的,小李必须测量的数据是 。A、锥形瓶质量 B、气球质量 C、反应前整个反应装置(包括里边的物质)质量 D、反应后整个反应装置(包括里边的物质)质量(2)、将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因:。(3)、反应结束后,锥形瓶中无固体剩余,则生成气体质量为g,所得溶液中生成物的溶质质量分数为(只需写出最终的计算表达式)。
(1)、根据实验目的,小李必须测量的数据是 。A、锥形瓶质量 B、气球质量 C、反应前整个反应装置(包括里边的物质)质量 D、反应后整个反应装置(包括里边的物质)质量(2)、将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中。反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因:。(3)、反应结束后,锥形瓶中无固体剩余,则生成气体质量为g,所得溶液中生成物的溶质质量分数为(只需写出最终的计算表达式)。三、实验探究题(26题每空2分,27题每空3分,共27分)
-
26. 根据下列实验装置图,结合所学化学知识回答问题。
 (1)、加热时酒精灯焰温度最高。(2)、实验室用氯酸钾和二氧化锰加热制取氧气,二氧化锰在反应前后的质量和都没有改变,根据氧气的物理性质可选择E装置收集氧气。选择B装置制取氧气时,反应的化学方程式为 , 收集气体前,应将集气瓶装满 , 并盖上;收集氧气还可以选择的装置是。(3)、通常情况下,NH3是一种无色、有刺激性气味的气体,极易溶于水且水溶液显碱性,密度比空气小。实验室里用氯化铵固体和氢氧化钙固体混合加热制取NH3。实验室制取NH3应选择的发生装置是(填字母),若选择F装置利用排空气法收集NH3 , 气体应该从(选填“a”或“b”)口进入。27. 小明发现二氧化锰催化过氧化氢分解的实验中,反应速度逐渐变慢,查阅资料得知:其原因是过氧化氢的溶质质量分数减小以及二氧化锰的催化能力降低,为了探究二氧化锰催化能力降低的影响因素,进行如下实验。
(1)、加热时酒精灯焰温度最高。(2)、实验室用氯酸钾和二氧化锰加热制取氧气,二氧化锰在反应前后的质量和都没有改变,根据氧气的物理性质可选择E装置收集氧气。选择B装置制取氧气时,反应的化学方程式为 , 收集气体前,应将集气瓶装满 , 并盖上;收集氧气还可以选择的装置是。(3)、通常情况下,NH3是一种无色、有刺激性气味的气体,极易溶于水且水溶液显碱性,密度比空气小。实验室里用氯化铵固体和氢氧化钙固体混合加热制取NH3。实验室制取NH3应选择的发生装置是(填字母),若选择F装置利用排空气法收集NH3 , 气体应该从(选填“a”或“b”)口进入。27. 小明发现二氧化锰催化过氧化氢分解的实验中,反应速度逐渐变慢,查阅资料得知:其原因是过氧化氢的溶质质量分数减小以及二氧化锰的催化能力降低,为了探究二氧化锰催化能力降低的影响因素,进行如下实验。【材料准备】取三份质量均为2g的二氧化锰分别催化40mL溶质质量分数为10%、20%、30%的过氧化氢溶液分解,实验后回收二氧化锰,并分别标为A、B、C;另取多次催化分解10%过氧化氢溶液后回收的二氧化锰,标为D。
【实验步骤】
①连接实验装置并检查气密性。

②取未使用过的二氧化锰0.5g,加入锥形瓶中,再加入10mL溶质质量分数为5%的过氧化氢溶液,记录收集120mL气体所需的时间。
③再分别取A、B、C、D四组二氧化锰各0.5g,重复上述实验。
④多次实验取平均值,记录数据见表:
组别
未使用过的二氧化锰
A
B
C
D
收集气体时间/s
17.9
23.2
27.7
32.3
37.8
(1)、实验时,长颈漏斗下端管口应在液面以下,其目的是。(2)、实验中,除通过比较收集相同体积气体所需的时间外,还可以通过比较来判断二氧化锰的催化能力。(3)、由表中数据可知,引起回收的二氧化锰催化能力下降的因素是。四、解答题(28题4分,29题5分,30、31题各8分,共25分)
-
28. 电解3.6g水,可以获得多少克氢气和多少克氧气?29. 黄铁矿矿石的主要成分为二硫化亚铁(FeS2)。取一块质量为30g的黄铁矿矿石样品在氧气中完全灼烧后,得到10g氧化铁(其中的铁全来自二硫化亚铁),同时生成二氧化硫。(1)、写出二硫化亚铁在氧气中完全灼烧的化学方程式:。(2)、计算黄铁矿矿石样品中二硫化亚铁的质量分数。30. 合成氨工业中,常用碳酸钾溶液吸收产生的二氧化碳得到碳酸氢钾,反应的化学方程式为K2CO3+CO2+H2O=2KHCO3。现向碳酸钾溶液通入二氧化碳,恰好完全反应,得到溶质质量分数为10%的溶液50g,试计算:(1)、碳酸钾中钾元素、碳元素、氧元素的质量比为。(2)、若把该50g溶液,稀释为溶质质量分数为4%的溶液,需要加入水的质量。(3)、原碳酸钾溶液中溶质的质量分数。(计算结果精确到0.1%)31. 取NaCl和Na2CO3的固体混合物25g溶于适量的蒸馏水中,滴入稀盐酸至恰好完全反应,得到10%的NaCl溶液272g。(化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑)求:(1)、反应后所得溶液中溶质的质量。(2)、原固体混合物中NaCl的质量分数。