专题06:钠及其化合物
试卷更新日期:2020-08-24 类型:一轮复习
一、单选题
-
1. 下列关于钠的叙述正确的是( )A、钠为银白色固体,熔点很高 B、钠在空气中燃烧,生成淡黄色的过氧化钠 C、钠可保存在酒精中 D、钠与CuSO4溶液反应,可置换出单质铜2. 表中,对陈述Ⅰ、Ⅱ的周期性及两者间是否具有因果关系的判断都正确的是( )
 A、A B、B C、C D、D3. 下列关于钠的描述中错误的是( )
A、A B、B C、C D、D3. 下列关于钠的描述中错误的是( )①自然界中的钠以单质和化合物的形式存在
②实验室剩余的钠需要放同原瓶
③钠的化学性质比较活泼,少量的钠可以保存在煤油中
④当钠与硫酸铜溶液反应时,有大量红色固体铜产生
⑤金属钠与O2反应,条件不同,产物不相同
⑥燃烧时放出白色火花,燃烧后生成浅黄色固体物质
⑦钠-钾合金通常状况下呈液态,可作原子反应堆的导热剂
A、①②④⑤⑥⑦ B、①④⑥ C、④⑤⑥ D、①⑥⑦4. 某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的( )①钠比水轻 ②钠的熔点较低 ③钠与水反应在时要放出热量 ④钠与水反应后溶液呈碱性
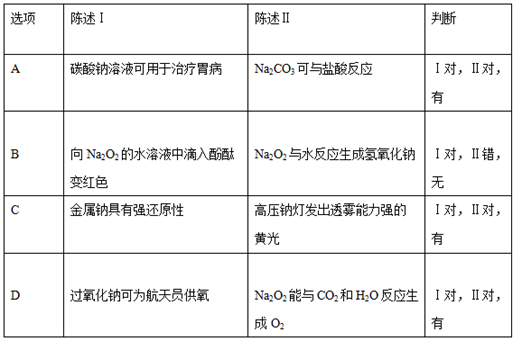
A、①④ B、①②④ C、①③④ D、①②③④5. 常温下,将一定量的钠铝合金置于水中,合金全部溶解,并放出氢气,得到 的溶液,然后用 的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法错误的是( )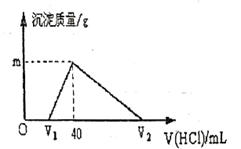 A、原合金质量为 B、产生氢气的体积为 (标准状况下) C、图中 的值为1.56 D、图中 为1006. 下列关于碳酸钠和碳酸氢钠的说法错误的是( )A、碳酸钠的热稳定性比碳酸氢钠强 B、相同温度时,碳酸钠的溶解度大于碳酸氢钠 C、同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液 D、碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠7. 金属钠在空气中燃烧生成过氧化钠,下列说法正确的是( )A、该反应过程中的能量变化如图所示
A、原合金质量为 B、产生氢气的体积为 (标准状况下) C、图中 的值为1.56 D、图中 为1006. 下列关于碳酸钠和碳酸氢钠的说法错误的是( )A、碳酸钠的热稳定性比碳酸氢钠强 B、相同温度时,碳酸钠的溶解度大于碳酸氢钠 C、同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液 D、碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠7. 金属钠在空气中燃烧生成过氧化钠,下列说法正确的是( )A、该反应过程中的能量变化如图所示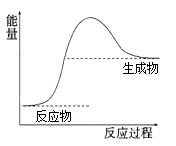 B、过氧化钠中阴、阳离子个数比为1:1
C、反应中每消耗1molO2转移2mol电子
D、过氧化钠与氧化钠所含化学键完全相同
8. 下列关于氧化钠和过氧化钠的叙述正确的是( )A、将Na2O与Na2O2分别加入滴有酚酞的水中,二者现象相同 B、在Na2O2与水的反应中,水是还原剂 C、相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1 D、等质量的Na2O与Na2O2投入等量且足量水中充分反应后所得溶液物质的量浓度相等9. 将过量的CO2通入下列溶液中,最终溶液是澄清的有( )
B、过氧化钠中阴、阳离子个数比为1:1
C、反应中每消耗1molO2转移2mol电子
D、过氧化钠与氧化钠所含化学键完全相同
8. 下列关于氧化钠和过氧化钠的叙述正确的是( )A、将Na2O与Na2O2分别加入滴有酚酞的水中,二者现象相同 B、在Na2O2与水的反应中,水是还原剂 C、相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1 D、等质量的Na2O与Na2O2投入等量且足量水中充分反应后所得溶液物质的量浓度相等9. 将过量的CO2通入下列溶液中,最终溶液是澄清的有( )①氯化钙溶液 ②硅酸钠溶液 ③偏铝酸钠溶液 ④饱和碳酸钠溶液 ⑤石灰水
A、①⑤ B、③④⑤ C、②③ D、①③10. 碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为( )A、3.38g B、4.58g C、4.16g D、4.41g11. 把金属钠加入到下列溶液中,还能大量共存的离子组是( )A、Na+、 、 B、 、Cu2+、Cl- C、K+、 、Cl- D、 、 、Cl-12. 现有2mol金属钠,一半与氧气发生反应生成氧化钠,另一半与氧气反应生成过氧化钠,则上述两个氧化还原反应过程中转移的电子数之比为( )A、1:2 B、2:1 C、1:1 D、4:113. 下列有关焰色反应及其操作的说法正确的是( )A、焰色反应是化学变化 B、Na与NaCl在灼烧时火焰颜色相同 C、铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验 D、用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+ , 没有K+二、综合题
-
14. 取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入CuSO4溶液中,观察实验现象并写出反应的化学方程式:(1)、钠与水反应的实验现象是。反应化学方程式是。(2)、加入CuSO4后,实验现象是 , 反应的化学方程式是。15. 化合物X由三种元素(其中一种是第四周期元素)组成,现进行如下实验:
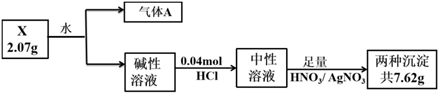
已知:气体A在标准状况下密度为0.714 g·L-1;碱性溶液焰色反应呈黄色。
(1)、X中非金属元素的名称为 , X的化学式。(2)、X与水反应的化学方程式为。(3)、化合物Y由X中金属元素和第四周期元素构成,设计实验证明Y的晶体类型。(4)、补充焰色反应的操作:取一根铂丝, , 蘸取待测液灼烧,观察火焰颜色。三、实验探究题
-
16. 过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。
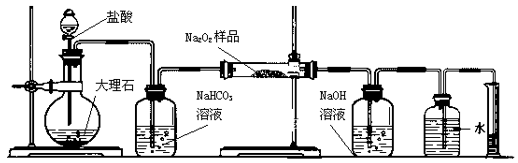
A
B
C
D
E
F
(1)、写出装置A中两种主要玻璃仪器的名称、。(2)、写出装置A中发生的离子方程式。(3)、装置B的作用是。(4)、写出装置C中发生反应的主要化学方程式:。(5)、装置D中 NaOH的作用是。(6)、他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为17. 氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。(1)、I.实验室通过如图所示装置制备Na2S2O3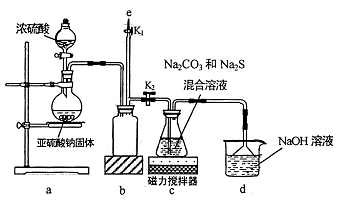
实验中要控制SO2生成速率,可采取的措施有(写出一条)。
(2)、b装置的作用是 。(3)、反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清;实验结束后,在e处最好连接盛(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为 , 最后拆除装置。(4)、II.氰化钠废水处理已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-=[Ag(CN)2]- , Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用(填仪器名称) 盛装; 滴定终点时的现象是。
②处理后的废水是否达到排放标准(填“是”或“否”)。