专题03:离子反应
试卷更新日期:2020-08-24 类型:一轮复习
一、单选题
-
1. 下列物质在熔融状态下不导电的是( )A、 B、 C、 D、2. 能正确表示下列变化的离子方程式是( )A、CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- B、用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO2-+H2↑ C、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ D、NaHSO4溶液中滴加Ba(OH)2至恰好完全沉淀:H++SO42-+Ba²++OH-=BaSO4↓+H2O3. 铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材作阴、阳极材料,经过电解处理形成氧化铝膜,抗蚀能力强。其制备的简要流程如图所示。下列用来解释流程中反应的方程式错误的是( )
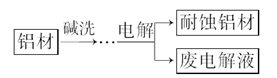 A、碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3=2AlO2-+H2O B、碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O=2AlO2-+3H2↑ C、获得耐蚀铝材的电极反应:4Al-12e-+3O2=2Al2O3 D、用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O+H+=NH4++H2O4. 下列指定反应的离子方程式正确的是( )A、Cl2通入水中制氯水: B、NO2通入水中制硝酸: C、 NaAlO2溶液中通入过量CO2: D、 AgNO3溶液中加入过量浓氨水:5. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、 氨水溶液:Na+、K+、OH-、NO B、 盐酸溶液:Na+、K+、SO 、SiO C、 KMnO4溶液:NH 、Na+、NO 、I- D、 AgNO3溶液:NH 、Mg2+、Cl-、SO6. Fe3+、 、Al3+和X四种离子以物质的量之比2∶4∶1∶1大量共存于同一溶液中,X可能是( )A、Na+ B、OH- C、CO32- D、Cl-7. 某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
A、碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3=2AlO2-+H2O B、碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O=2AlO2-+3H2↑ C、获得耐蚀铝材的电极反应:4Al-12e-+3O2=2Al2O3 D、用稀氨水洗去耐蚀铝材表面的酸:NH3·H2O+H+=NH4++H2O4. 下列指定反应的离子方程式正确的是( )A、Cl2通入水中制氯水: B、NO2通入水中制硝酸: C、 NaAlO2溶液中通入过量CO2: D、 AgNO3溶液中加入过量浓氨水:5. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、 氨水溶液:Na+、K+、OH-、NO B、 盐酸溶液:Na+、K+、SO 、SiO C、 KMnO4溶液:NH 、Na+、NO 、I- D、 AgNO3溶液:NH 、Mg2+、Cl-、SO6. Fe3+、 、Al3+和X四种离子以物质的量之比2∶4∶1∶1大量共存于同一溶液中,X可能是( )A、Na+ B、OH- C、CO32- D、Cl-7. 某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验: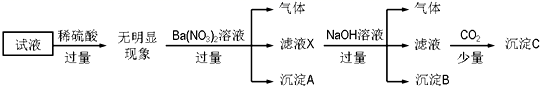
下列说法正确的是( )
A、无法确定原试液中是否含有Al3+、Cl- B、滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ C、无法确定沉淀C的成分 D、原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-8. 在溶液中加入过量Na2O2后仍能大量共存的是( )A、NH4+、Ba2+、Cl-、NO3- B、K+、CO32-、AlO2-、SO42- C、Fe2+、Mg2+、SCN-、Cl- D、Na+、HCO3-、SO32-、I-9. 镁、铝、铜三种金属混合物粉末,加入过量盐酸充分反应过滤后,向滤液中加入过量烧碱溶液,再过滤,滤液中(除Na+、Cl-外)存在大量离子有( )A、Mg2+ B、Cu2+ C、Al3+ D、AlO2-10. 下列离子方程式书写及评价合理的是( )选项
离子方程式
评价
A
溶液中加入足量 溶液
正确, 过量,酸式盐与碱完全反应生成正盐和水:
B
的 溶液与 的 溶液等体积混合
正确, 与H按物质的量1:1反应转化为 ,过量的 再将一半 转化为
C
将少量的 溶解在过量的稀 中
正确, 化学式可改写为 , 与 ,物质的量之比为1:2
D
将 溶液加入到足量的 溶液中
错误, 与 发生氧化还原反应:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+
A、A B、B C、C D、D11. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、含有0.1 mol•L﹣1Fe3+的溶液中:K+、Mg2+、I﹣、SO42﹣ B、c(Al3+)=0.5 mol•L﹣1的溶液中:Na+、K+、AlO2﹣、SO42﹣ C、能使酚酞变红的溶液:Na+、Ba2+、NO3﹣、Cl﹣ D、能溶解Al(OH)3的溶液:NH4+、K+、SO42﹣、HCO3﹣二、推断题
-
12. 某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO 、CO 、SO 中的若干种离子组成,取溶液进行如下连续实验:
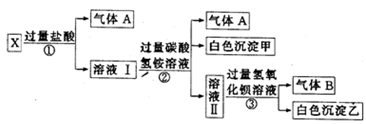 (1)、气体A的成分是(填电子式),气体B的成分是(填结构式)(2)、X溶液中一定不存在的离子是。(3)、写出步骤①中发生反应的所有离子方程式:。(4)、写出步骤②中形成白色沉淀的离子方程式:。(5)、通过上述实验,溶液X中不能确定是否存在的离子是;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是。
(1)、气体A的成分是(填电子式),气体B的成分是(填结构式)(2)、X溶液中一定不存在的离子是。(3)、写出步骤①中发生反应的所有离子方程式:。(4)、写出步骤②中形成白色沉淀的离子方程式:。(5)、通过上述实验,溶液X中不能确定是否存在的离子是;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是。三、综合题
-
13. 按要求回答下列问题:(1)、Ⅰ.将NaHSO4溶液滴入到Ba(OH)2溶液中至中性的离子方程式:(2)、将5-6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体。写出反应的离子方程式:(3)、在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是(用离子方程式表示)。(4)、向Na2S2O3 中加入稀硫酸反应的离子方程式。(5)、Ⅱ.金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物
Cr2O
Cr(OH)3
Cr3+
CrO2-
CrO
颜色
橙色
灰蓝色
蓝紫色
绿色
黄色
含铬元素的化合物可以发生如图一系列变化:
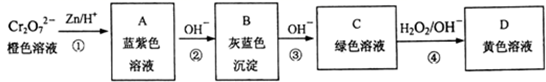
①写出反应④的离子方程式:。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为。
(6)、Ⅲ.二氧化硫是常见大气污染气体,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。第一步:用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应Na2SO3+CaO+H2O=CaSO3↓+2NaOH
若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的离子方程式
14. 亚硝酰氯(NOCl)是一种黄色气体,沸点为-5.5℃。其液体呈红褐色。遇水发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑。某化学兴趣小组设计下图装置用Cl2和NO制备NOCl。回答下列相关问题: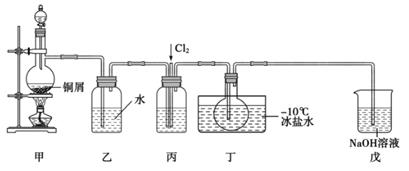 (1)、甲装置发生的离子反应方程式为 , 装置丙中的液体为。(2)、实验时,先通入Cl2 , 待丁中烧瓶内充满黄绿色气体时,再通入NO.这样做的目的是 。(3)、装置丁中冰盐水的作用是 。(4)、经分析该套装置设计上有一处明显缺陷.改进方法是 (用文字描述)。(5)、吸收尾气时,NOCl发生反应的化学方程式为。
(1)、甲装置发生的离子反应方程式为 , 装置丙中的液体为。(2)、实验时,先通入Cl2 , 待丁中烧瓶内充满黄绿色气体时,再通入NO.这样做的目的是 。(3)、装置丁中冰盐水的作用是 。(4)、经分析该套装置设计上有一处明显缺陷.改进方法是 (用文字描述)。(5)、吸收尾气时,NOCl发生反应的化学方程式为。(已知:NO+NO2+2NaOH=2NaNO2+H2O)
(6)、反应完成后,取烧瓶中所得产物mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为VmL。则产物中NOCl纯度的计算式为。15. X、Y、Z是阳离子,K是阴离子,M、N 是中性分子。它们都由短周期组成,且具有以下结构特征和性质:①它们核外电子总数都相同;
②N 溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y 核内质子总数比K多两个;
④X和N 都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失
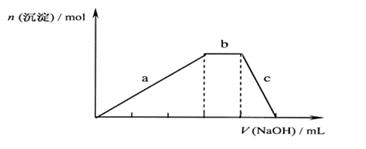
(1)、Y的化学式为 检验X 的离子的方法 (用离子方程式表示)(2)、试比较M和N 的稳定性:M N(3)、写出Z和N 的水溶液反应的离子方程式(4)、上述六种微粒中的两种阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入 0.1mol/L 的NaOH 溶液,出现了如右图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为
(5)、将1.92g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到672mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积 mL
-