湖南省株洲市醴陵二中、醴陵四中联考2016-2017学年高一上学期化学期中考试试卷
试卷更新日期:2017-09-23 类型:期中考试
一、选择题
-
1. 碘元素的一种核素 可用于治疗肿瘤.下列有关 的说法正确的是( )A、质量数是53 B、质子数是125 C、中子数是125 D、电子数是532. 下列关于元素周期表的说法正确的是( )A、能生成碱的金属元素都在ⅠA族 B、稀有气体元素原子的最外层电子数均为8 C、第二周期ⅣA族元素的原子核电荷数和种子数一定为6 D、原子序数为14的元素位于元素周期表的第3周期ⅣA族3. 同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4 , 则下列说法中,正确的是( )A、原子半径:X>Y>Z B、非金属性:X>Y>Z C、气态氢化物的稳定性:ZH3>H2Y>HX D、原子序数:Z>Y>X4. 下列微粒中,与NH4+的电子总数和质子总数都相同的是( )A、Na+ B、F C、OH﹣ D、CH45. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左下方区域的金属元素 B、右上方区域的非金属元素 C、金属元素和非金属元素分界线附近的元素 D、稀有气体元素6. X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )A、原子序数X<Y B、原子半径X<Y C、离子半径X>Y D、原子最外层电子数X<Y7. 下列化学用语表示正确的是( )A、氯化钠的电子式
 B、次氯酸的电子式
B、次氯酸的电子式 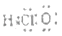 C、HCl分子的电子式
C、HCl分子的电子式  D、氯原子的结构示意图
D、氯原子的结构示意图  8. 对于反应N2(g)+3H2(g)═2NH3(g),下列化学反应速率的表示中,所表示的反应速率最快的是( )A、v(N2)=0.40 mol•L﹣1•s﹣1 B、v(H2)=0.80 mol•L﹣1•s﹣1 C、v(H2)=0.60 mol•L﹣1•s﹣1 D、v(NH3)=1.2 mol•L﹣1•min﹣19.
8. 对于反应N2(g)+3H2(g)═2NH3(g),下列化学反应速率的表示中,所表示的反应速率最快的是( )A、v(N2)=0.40 mol•L﹣1•s﹣1 B、v(H2)=0.80 mol•L﹣1•s﹣1 C、v(H2)=0.60 mol•L﹣1•s﹣1 D、v(NH3)=1.2 mol•L﹣1•min﹣19.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
 A、铜片表面有气泡生成 B、装置中存在“化学能→电能→光能”的转换 C、如果将硫酸换成柠檬汁,导线中不会有电子流动 D、如果将锌片换成铁片,电路中的电流方向不变10. 金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量.已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2 , 下列说法错误的是( )A、Q1<Q2 B、石墨不如金刚石稳定 C、石墨具有的能量比金刚石低 D、完全燃烧,生成的二氧化碳一样多11. 在密闭容器中进行反应:X2(g)+3Y2(g)⇌2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.2mol•L﹣1 , 在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )A、c(Z)=0.5 mol•L﹣1 B、c(Y2)=0.5 mol•L﹣1 C、c(X2)=0.2 mol•L﹣1 D、c(Y2)=0.6 mol•L﹣112. X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为( )A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X13. 100mL 6mol/L硫酸溶液与过量锌粒反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采取的措施是( )A、加入少量碳酸钠粉末 B、加入少量硫酸铜溶液 C、加入适量NaCl溶液 D、加热14. 将一定量的SO2和O2放入一定体积的密闭容器中,500℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)⇌2SO3(g),不能作为判断该反应达到平衡状态的标志是( )A、容器中气体密度保持不变 B、容器中混合气体的平均相对分子质量保持不变 C、容器中气体的压强保持不变 D、单位时间内,消耗amol O2的同时生成2amol SO215. 在2L密闭容器中发生反应N2+3H2⇋2NH3 , 经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )A、6 s B、4 s C、3 s D、2 s16. 一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )A、反应进行30s时,正反应速率等于逆反应速率 B、反应进行80s时,逆反应速率大于正反应速率 C、以X浓度变化表示的反应速率为0.001mol/(L•s) D、反应进行80s时,X物质的量浓度为0.04mol/L
A、铜片表面有气泡生成 B、装置中存在“化学能→电能→光能”的转换 C、如果将硫酸换成柠檬汁,导线中不会有电子流动 D、如果将锌片换成铁片,电路中的电流方向不变10. 金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量.已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2 , 下列说法错误的是( )A、Q1<Q2 B、石墨不如金刚石稳定 C、石墨具有的能量比金刚石低 D、完全燃烧,生成的二氧化碳一样多11. 在密闭容器中进行反应:X2(g)+3Y2(g)⇌2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.2mol•L﹣1 , 在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )A、c(Z)=0.5 mol•L﹣1 B、c(Y2)=0.5 mol•L﹣1 C、c(X2)=0.2 mol•L﹣1 D、c(Y2)=0.6 mol•L﹣112. X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为( )A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X13. 100mL 6mol/L硫酸溶液与过量锌粒反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采取的措施是( )A、加入少量碳酸钠粉末 B、加入少量硫酸铜溶液 C、加入适量NaCl溶液 D、加热14. 将一定量的SO2和O2放入一定体积的密闭容器中,500℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)⇌2SO3(g),不能作为判断该反应达到平衡状态的标志是( )A、容器中气体密度保持不变 B、容器中混合气体的平均相对分子质量保持不变 C、容器中气体的压强保持不变 D、单位时间内,消耗amol O2的同时生成2amol SO215. 在2L密闭容器中发生反应N2+3H2⇋2NH3 , 经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )A、6 s B、4 s C、3 s D、2 s16. 一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )A、反应进行30s时,正反应速率等于逆反应速率 B、反应进行80s时,逆反应速率大于正反应速率 C、以X浓度变化表示的反应速率为0.001mol/(L•s) D、反应进行80s时,X物质的量浓度为0.04mol/L二、填空题
-
17. 在Cl2、Na2S、Na2O2、HClO、H2O2、NH4Cl六种物质中:(1)、其中只含非极性键的物质的电子式为;(2)、其中只由极性键构成的物质是(填化学式);(3)、其中由离子键和共价键构成的物质是(填化学式);(4)、H2O2属于共价化合物,其结构式为;(5)、用电子式表示Na2S的形成过程 .18. 六种短周期元素A、B、C、D、E、F的原子序数依次增大,A和D同族,B和E同族,B和C相邻,D离子和B离子具有相同的电子层结构.A和B、C、E、F均能形成共价型化合物.A和B形成的化合物在水中呈碱性,D和F形成的化合物是烹饪中最常用的调味料.回答下列问题:(1)、E元素在周期表中的位置是 .(2)、B、C、D、E元素原子半径由大到小的顺序是(用元素符号表示).(3)、A和F形成的化合物与A和B形成的化合物反应,产物的化学式为 .(4)、单质F与水反应的离子方程式为 .(5)、下列选项中能作为判断B和E的非金属性强弱的依据有(填字母编号) .
a.B和E的单质的熔点高低 b.B和E的氢化物的稳定性强弱
c.B和E的单质与氧气反应的难易 d.B和E的最高价氧化物对应的水化物的酸性强弱.
19.如图为原电池装置示意图:
 (1)、若A为Zn,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式 .(2)、若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为极(填正或负),写出该电极反应式: .(3)、若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2 , 该电池即为燃料电池,通入氧气的一极为该电池的极(填正或负),该电池的负极反应式为: .20.
(1)、若A为Zn,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式 .(2)、若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为极(填正或负),写出该电极反应式: .(3)、若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2 , 该电池即为燃料电池,通入氧气的一极为该电池的极(填正或负),该电池的负极反应式为: .20.698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)═2HI(g),测得各物质的物质的量浓度与时间变化的关系如图所示.请回答下列问题:
 (1)、容器的体积V=L.(2)、反应达到最大限度的时间是s,该时间内平均反应速率v(HI)=mol•L﹣1•s﹣1(3)、判断该反应达到平衡的依据是 (填序号)
(1)、容器的体积V=L.(2)、反应达到最大限度的时间是s,该时间内平均反应速率v(HI)=mol•L﹣1•s﹣1(3)、判断该反应达到平衡的依据是 (填序号)①v正(I2)=2v逆(HI)
②H2、I2、HI的浓度都不变
③容器内气体的压强保持不变
④容器内气体的密度保持不变.
21.某实验小组同学进行如下实验,以检验化学反应中的能量变化.
请回答下列问题:
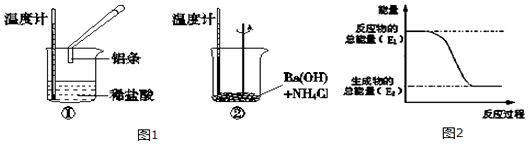 (1)、实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)2•8H2O与NH4Cl的反应是 热反应.反应过程
(1)、实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)2•8H2O与NH4Cl的反应是 热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.
(2)、一定量的氢气在氧气中充分燃烧并放出热量.若生成气态水放出的热量为Q1;生成液态水放出的热量为Q2 . 那么Q1Q2(填“大于”、“小于”或“等于”).(3)、已知:4HCl+O2═2Cl2+2H2O,该反应中,4mol HCl被氧化,放出115.6kJ的热量.则断开1mol H﹣O键与断开1mol H﹣Cl键所需能量相差约为kJ.
