高中化学人教版(新课标)选修4 第二章第四节 化学反应进行的方向
试卷更新日期:2020-08-20 类型:同步测试
一、单选题
-
1. 下列关于古籍中的记载说法错误的是( )A、《天工开物》中“凡石灰,经火焚炼为用”涉及的反应类型是分解反应 B、《吕氏春秋•别类编》中“金(即铜)柔锡柔,合两柔则刚”体现了合金硬度方面的特性 C、《抱朴子》中“丹砂烧之成水银,积变又还成丹砂”两个反应互为可逆反应 D、《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油2. 对于温度与反应方向的关系,下列判断不正确的是( )A、△H<0 ,△S>0,所有温度下反应自发进行 B、△H>0 ,△S>0,所有温度下反应自发进行 C、△H<0 ,△S<0,低温下反应自发进行 D、△H>0 ,△S<0,所有温度下反应不能自发进行3. 某同学为探究FeCl3与KI反应是否存在反应限度,设计了如下实验方案(FeCl3溶液、KI溶液浓度均为0.1mol·L-1),最合理的方案是( )
 A、方案1 B、方案2 C、方案3 D、方案44. 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2 , 在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
A、方案1 B、方案2 C、方案3 D、方案44. 在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2 , 在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )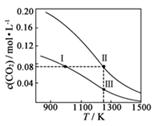 A、反应CO2(g)+C(s) 2CO(g)的ΔS>0、ΔH<0 B、体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) C、体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D、逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ )5. 将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
A、反应CO2(g)+C(s) 2CO(g)的ΔS>0、ΔH<0 B、体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ) C、体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) D、逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ )5. 将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。压强/MPa
体积分数/%
温度/℃
1.0
2.0
3.0
810
54.0
a
b
915
c
75.0
d
1000
e
f
83.0
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A、4个 B、3个 C、2个 D、1个6. 下列说法中正确的是( )A、熵增加且放热的反应一定是自发反应 B、自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应 C、凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应 D、非自发反应在任何条件下都不能发生7. 一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2+ 3H2 2NH3(正反应是放热反应)。下列有关说法正确的是( )
A、降低温度可以加快反应速率 B、达到化学反应限度时,生成2mol NH3 C、向容器中再加入N2可以加快反应速率 D、1mol N2和3mol H2的总能量低于2mol NH3的总能量8. 下列反应均可在室温下自发进行,其中△H>0,△S>0的是( )A、4Fe(s)+3O2(g)=2Fe2O3(s) B、NH3(g)+HCl(g)=NH4Cl(s) C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) D、2Cu(s)+CO2(g)+O2(g)+H2O(g)=Cu2(OH)2CO3(s)二、综合题
-
9. 试判断下列体系的熵变是大于0,还是小于0。(1)、水蒸气冷凝成水;(2)、CaCO3(s)=CaO(s)+CO2(g);(3)、乙烯聚合成聚乙烯(4)、N2O4(g)=2NO2(g)10. 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视。(1)、目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
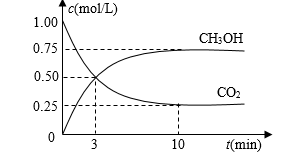
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)。
②该反应的平衡常数表达式为K=。
③下列措施中能使n(CH3OH)/n(CO2)增大的是。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(2)、有人提出,可以设计反应2CO(g)=2C(s)+O2(g) 通过其自发进行来消除CO的污染。该方案(填“是”、“否”)可行,理由是:。11. 含氮物质被广泛应用于化肥、制药、合成纤维等化工行业造福人类,但如果使用或处理不当,也会对环境造成影响。如何合理地使用含氮物质,是化学学科肩负的重要社会责任。请根据所学知识解答下列问题:(1)、卫星发射时,可用N2H4和F2作推进剂,已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H1=-534kJ·mol-1
1/2H2(g)+1/2F2(g)=HF(g) △H2=-269kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-484kJ·mol-1
则该条件下N2H4(g)和F2(g)反应的热化学方程式为:。
(2)、工业合成氨的原理为N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1 , 现将6molN2和14molH2充入下图所示恒压密闭容器中,开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示。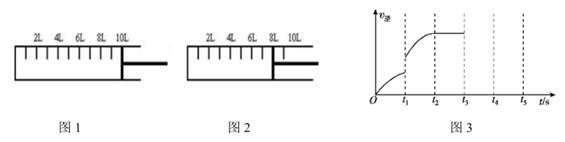
①下列表述能说明反应已达平衡的是。
A.活塞不再移动
B.容器内压强不再改变
C.容器内气体密度不再改变
D.容器内气体的平均相对分子质量不再改变
②试计算该条件下反应的平衡常数:。
③已知某次反应过程中逆反应速率随时间的变化图如图3所示。在t1时改变了某一种条件,则改变的条件可能是。
(3)、治理NO的一种方法是先将NO氧化成NO2后,再在电解条件下通入还原性碱溶液转化成N2 , 其中重要的一步反应原理为NO(g)+O3(g) NO2(g)+O2(g)△H<0①下列说法正确的是。
A.已知该反应在较低温度下能自发进行,说明ΔS=0
B.加入催化剂,可降低反应的活化能和焓变,从而加快反应的速率
C.活化分子有效碰撞理论中,活化能指活化分子的平均能量与非活化分子平均能量的差值
D.在一定温度下,向恒容密闭容器中充入物质的量之比为1:3的NO和O3 , 达到平衡时转化率为a。
再充为入了1:3探的究NO和O3 , 转化率不变
②为了探究臭氧投加量对NO氧化脱除的影响,对一定时间内O3/NO的物质的量比值与NO脱除率进行了研究,结果如图4所示。
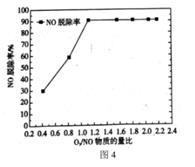
当O3/NO的物质的量比值小于1.1时,NO的脱除率随物质的量比的增大快速升高的原因可能是:。
(4)、处理汽车尾气中的氮氧化物还可以用NH3还原法,假设在恒容密闭容器中,仅发生反应4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H<0。测得NO的平衡转化率随温度的变化关系如图5所示,已知温度为T3时,反应达到平衡所需时间为10min。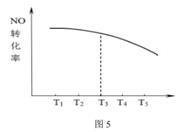
请在图5中画出不同温度下,反应都经10min,NO的转化率曲线示意图。