高中化学人教版(新课标)选修4 第二章第三节 化学平衡
试卷更新日期:2020-08-20 类型:同步测试
一、单选题
-
1. T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(s)+Y(g) 2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是( )A、在第10 min时,Z的反应速率为0.02 mol·L-1·min-1 B、在0~10 min内,Y的反应速率为 mol·L-1·min-1 C、增加X的物质的量可以加快反应速率 D、反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快2. 在一定温度下,可逆反应:A2(g)+B2(g) 2AB(g),达到平衡的标志是( )A、容器的总压强不随时间而变化 B、单位时间内生成nmolA2同时就有2nmolAB生成 C、单位时间内有nmolB2发生反应的同时有nmolAB分解 D、单位时间内有nmolA2生成的同时有nmolB2生成3. 一定条件下,物质的量均为0.3mol的X(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) 2Z(g),ΔH=-akJ·mol-1 , 下列说法正确的是( )A、反应一段时间后,X与Y的物质的量之比仍为1:1 B、达到平衡时,反应放出0.1akJ的热量 C、达到平衡后,向平衡体系中充入稀有气体,正反应速率不发生变化 D、X的体积分数保持不变,说明反应已达到平衡4. 下列事实中,不能应用化学平衡移动原理来解释的是( )
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI (g)
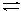 H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深A、②③⑤ B、②⑤ C、④⑤ D、①②③5. 一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )A、只有③④ B、只有②③④ C、只有①②③④ D、①②③④⑤6. 在2A(g)+B(g) 4C(g)+D(s)-Q已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施( )A、增大压强 B、增大C的浓度 C、使用催化剂 D、升高温度7. 一定条件下,向密闭容器中充入等物质的量的CO和H2O(g)发生反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0并建立平衡。下列叙述正确的是( )A、降低温度平衡正向移动,正反应速率增大而逆反应速率减小 B、保持恒温恒压充入少量氦气,正逆反应速率同等程度的减小 C、保持恒温恒容再充入CO和H2O(g)各1mol,CO的平衡转化率增大 D、若容器是绝热容器,平衡后充入CO,平衡常数会增大8. 已知反应3A(g)+B(g) 2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是( )
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深A、②③⑤ B、②⑤ C、④⑤ D、①②③5. 一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )A、只有③④ B、只有②③④ C、只有①②③④ D、①②③④⑤6. 在2A(g)+B(g) 4C(g)+D(s)-Q已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施( )A、增大压强 B、增大C的浓度 C、使用催化剂 D、升高温度7. 一定条件下,向密闭容器中充入等物质的量的CO和H2O(g)发生反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0并建立平衡。下列叙述正确的是( )A、降低温度平衡正向移动,正反应速率增大而逆反应速率减小 B、保持恒温恒压充入少量氦气,正逆反应速率同等程度的减小 C、保持恒温恒容再充入CO和H2O(g)各1mol,CO的平衡转化率增大 D、若容器是绝热容器,平衡后充入CO,平衡常数会增大8. 已知反应3A(g)+B(g) 2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是( )
①增大A的浓度 ②升高温度 ③增大D浓度 ④加入催化剂 ⑤恒温下,缩小反应容器体积 ⑥加入稀有气体,保持容器内压强不变
A、①②③ B、④⑤ C、③④⑤ D、④⑤⑥9. 一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )选项
正反应速率
逆反应速率
A
vA=2 mol·L-1·min-1
vB=2 mol·L-1·min-1
B
vA=2 mol·L-1·min-1
vC=2 mol·L-1·min-1
C
vA=1 mol·L-1·min-1
vB=2 mol·L-1·min-1
D
vA=1 mol·L-1·min-1
vC=1.5 mol·L-1·min-1
A、A B、B C、C D、D10. 某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g);△H<0.上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中错误的是( ) A、 时加入了催化剂 B、 时降低了温度 C、 时增大了压强 D、 时间内转化率最高11. 如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图像为(注:Φ(C)表示C的体积分数,P表示气体压强,C表示浓度)( )A、
A、 时加入了催化剂 B、 时降低了温度 C、 时增大了压强 D、 时间内转化率最高11. 如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图像为(注:Φ(C)表示C的体积分数,P表示气体压强,C表示浓度)( )A、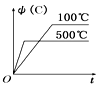 B、
B、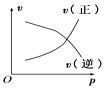 C、
C、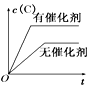 D、
D、
二、综合题
-
12. 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
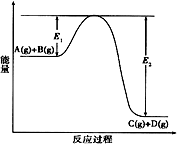 (1)、该反应是反应(填“吸热”“放热”)。(2)、当反应达到平衡时,升高温度,A的转化率(填“增大”、“减小”或“不变”),原因。(3)、反应体系中加入催化剂对反应热是否有影响?13. t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g) + xB(g) C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:(1)、x=。(2)、用A表示该反应的速率为mol/(L·min)。(3)、若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是______________________(填写下列选项字母符号)。A、化学平衡向正反应方向移动 B、化学平衡向逆反应方向移动 C、化学平衡不会发生移动 D、正、逆反应的化学反应速率将发生同等程度的改变14. 在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
(1)、该反应是反应(填“吸热”“放热”)。(2)、当反应达到平衡时,升高温度,A的转化率(填“增大”、“减小”或“不变”),原因。(3)、反应体系中加入催化剂对反应热是否有影响?13. t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g) + xB(g) C(g),4min时反应达到平衡状态(温度不变),剩余0.4 mol B,并测得C的浓度为0.4mol/L。请填写下列空白:(1)、x=。(2)、用A表示该反应的速率为mol/(L·min)。(3)、若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是______________________(填写下列选项字母符号)。A、化学平衡向正反应方向移动 B、化学平衡向逆反应方向移动 C、化学平衡不会发生移动 D、正、逆反应的化学反应速率将发生同等程度的改变14. 在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。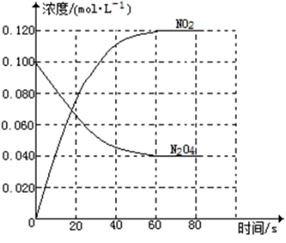
回答下列问题:
(1)、反应的△H0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为mol·L-1·s-1反应的平衡常数K1为。(2)、100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。①T100℃(填“大于”“小于”),判断理由是。
②列式计算温度T是反应的平衡常数K2
(3)、温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断理由是。15. 已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其化学平衡常数为K2 , 在温度973 K和1 173 K的情况下,K1、K2的值分别如下:温度
K1
K2
973 K
1.47
2.38
1 173 K
2.15
1.67
请填空:
(1)、反应①的K1表达式是。(2)、现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),该反应的平衡常数K3 , 根据反应①与②可推导出K1、K2与K3之间的关系式为 , 据此关系式及上表数据,能推断出反应③是(填“吸热”或“放热”)反应。(3)、能判断反应③一定处于化学平衡状态的依据是 (填写字母序号)。A、压强不随时间改变 B、气体密度不随时间改变 C、H2的体积分数不随时间改变 D、单位时间内生成H2和H2O(g)的物质的量相等(4)、图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是。
②图乙中t2时刻发生改变的条件是。
(5)、一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向移动(填“不”、“逆反应方向”或“正反应方向”)16. 新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:(1)、煤的气化和液化可以提高燃料的利用率。已知25℃、101kPa时:
①C(s)+ O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=。
(2)、高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0 已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
(3)、目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。 现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2 , 反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=。
②下列措施能使 增大的是(填字母)。
A.升高温度
B.再充入H2C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大