高中化学人教版(新课标)选修4 第二章第二节 影响化学反应速率的因素
试卷更新日期:2020-08-20 类型:同步测试
一、单选题
-
1. 决定化学反应速率的主要因素是( )A、反应物的性质 B、反应温度 C、使用催化剂 D、反应物的浓度2. 在标准状况下,将5.6 g铁粉投入100 mL 2 mol·L-1稀硫酸中,2 min时铁粉恰好完全溶解。关于该反应的速率,四位同学提出了四种表示方法:
甲 v(Fe)=2.8 g·min-1; 乙 v(H2SO4)=1 mol·L-1·min-1;
丙 v(FeSO4)=0.5 mol·L-1·min-1;
丁 v(H2)=1.12 L·min-1。
下列说法正确的是( )
A、甲错误,因为固体物质不能用来表示反应速率 B、丁错误,因为速率的单位错误 C、只有乙错误 D、只有丙正确3. 温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是( )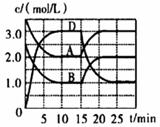 A、反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1 B、该反应方程式中的x=2 C、若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动 D、反应至15min时,改变的条件是降低温度4. 反应4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) 在2 L的密闭容器中进行,1分钟后,NH3减少了0.12 mol,则平均每秒钟各物质浓度变化正确的是( )A、NO:0.001 mol·L-1 B、H2O:0.002 mol·L-1 C、NH3:0.002 mol·L-1 D、O2:0.001 mol·L-15. 一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g) 4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是( )
A、反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1 B、该反应方程式中的x=2 C、若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动 D、反应至15min时,改变的条件是降低温度4. 反应4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) 在2 L的密闭容器中进行,1分钟后,NH3减少了0.12 mol,则平均每秒钟各物质浓度变化正确的是( )A、NO:0.001 mol·L-1 B、H2O:0.002 mol·L-1 C、NH3:0.002 mol·L-1 D、O2:0.001 mol·L-15. 一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g) 4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是( )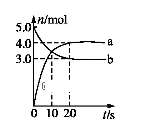 A、曲线a表示NO2的物质的量随反应时间的变化 B、0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1 C、10 s时,正、逆反应速率相等,达到平衡 D、20 s时,正反应速率大于逆反应速率6. (CH3)3CBr水解反应的能量与反应进程如图所示:下列说法正确的是( )
A、曲线a表示NO2的物质的量随反应时间的变化 B、0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1 C、10 s时,正、逆反应速率相等,达到平衡 D、20 s时,正反应速率大于逆反应速率6. (CH3)3CBr水解反应的能量与反应进程如图所示:下列说法正确的是( )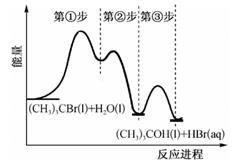 A、三步反应△H均小于0 B、反应的中间体只有1种 C、第①步的反应速率最快 D、第②步反应的活化能最小7. 相同温度下,下列各组的反应中,前者速率一定大于后者的是( )A、10 mL 4 mol·L-1的NaHCO3溶液+10 mL 2 mol·L-1盐酸+20 mL水与20 mL 3 mol·L-1的NaHCO3溶液+10 mL 2 mol·L-1盐酸+10 mL水 B、同品质等质量的两份Al(OH)3分别与2 mol·L-1硫酸、2 mol ·L-1盐酸反应 C、表面积完全相同的两块钠分别与200 mL、100 mL水反应 D、0.5 mol·L-1的NaHCO3溶液分别与1 mol·L-1盐酸和0.5 mol·L-1硫酸混合8. 四个试管中都装有5mL0.1mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1mol·L-1硫酸和一定量水,最先出现浑浊的是( )A、20℃,10mL硫酸 B、20℃,5mL硫酸,5mL水 C、30℃,5mL硫酸,2mL水 D、30℃,4mL硫酸,3mL水9. 在C(s)+CO2(g) 2CO(g)的反应中,采取下列措施:能够使反应速率增大的措施是( )
A、三步反应△H均小于0 B、反应的中间体只有1种 C、第①步的反应速率最快 D、第②步反应的活化能最小7. 相同温度下,下列各组的反应中,前者速率一定大于后者的是( )A、10 mL 4 mol·L-1的NaHCO3溶液+10 mL 2 mol·L-1盐酸+20 mL水与20 mL 3 mol·L-1的NaHCO3溶液+10 mL 2 mol·L-1盐酸+10 mL水 B、同品质等质量的两份Al(OH)3分别与2 mol·L-1硫酸、2 mol ·L-1盐酸反应 C、表面积完全相同的两块钠分别与200 mL、100 mL水反应 D、0.5 mol·L-1的NaHCO3溶液分别与1 mol·L-1盐酸和0.5 mol·L-1硫酸混合8. 四个试管中都装有5mL0.1mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1mol·L-1硫酸和一定量水,最先出现浑浊的是( )A、20℃,10mL硫酸 B、20℃,5mL硫酸,5mL水 C、30℃,5mL硫酸,2mL水 D、30℃,4mL硫酸,3mL水9. 在C(s)+CO2(g) 2CO(g)的反应中,采取下列措施:能够使反应速率增大的措施是( )①缩小体积,增大压强②增加碳的量③恒容通入CO2④恒容下充入N2⑤恒压下充入N2
A、①④ B、②③⑤ C、①③ D、①②④10. 少量铁片与l00mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O②加KNO3溶液③滴入几滴浓盐酸④加入少量铁粉⑤加NaCl溶液⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸
A、①⑥⑦ B、③⑤⑧ C、③⑦⑧ D、③④⑥⑦⑧11. 用3 g块状大理石与30 mL 3 mol·L-1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )①再加入30 mL 3 mol·L-1盐酸 ②改用30 mL 6 mol·L-1盐酸
③改用3 g粉末状大理石 ④适当升高温度
A、①②④ B、②③④ C、①③④ D、①②③二、综合题
-
12. 在一体积为2L的密闭容器中A、B两种气体反应生成C、D两种气体的可逆反应3A+B xC+2D的体系中,若一开始在体系中冲入3molA和3molB气体,2min末反应达到平衡状态,生成1molD,并测得C的浓度为0.5mol/L。由此推断:(1)、x值等于。(2)、平衡时B的浓度为。(3)、生成D的反应速率。(4)、试计算反应前和平衡时气体压强之比为:。13. 向2L恒容密闭容器中加入1molNO和1molO3 , 发生反应 。在不同温度下,分别测定体系中NO2的百分含量 随反应时间的变化如图。
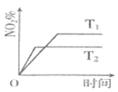 (1)、T1 , 0, 填“ ”、“ ”或“ ” 理由是;(2)、温度为 时,反应2min时达到平衡状态。测得2min内, ,则平衡时NO的转化率 ;(3)、下列情况能表明该反应达到平衡状态的是______ 填代号 ;A、NO消耗速率等于 的生成速率 B、 : :1 C、气体密度保持不变 D、容器内气体颜色不再变化(4)、该反应达到平衡后,为加快反应速率同时提高NO的转化率,可采取的措施有______ 填标号A、使用高效催化剂 B、升高温度 C、再充人一定量的 D、缩小容器的体积14. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
(1)、T1 , 0, 填“ ”、“ ”或“ ” 理由是;(2)、温度为 时,反应2min时达到平衡状态。测得2min内, ,则平衡时NO的转化率 ;(3)、下列情况能表明该反应达到平衡状态的是______ 填代号 ;A、NO消耗速率等于 的生成速率 B、 : :1 C、气体密度保持不变 D、容器内气体颜色不再变化(4)、该反应达到平衡后,为加快反应速率同时提高NO的转化率,可采取的措施有______ 填标号A、使用高效催化剂 B、升高温度 C、再充人一定量的 D、缩小容器的体积14. 一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示: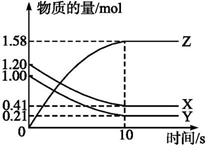 (1)、写出该反应的化学方程式。(2)、计算反应开始到10 s,用X表示的反应速率是 , Y的转化率为。(3)、下列叙述中能说明上述反应达到平衡状态的是____。A、当X与Y的反应速率之比为1:1 B、在混合气体中X的质量百分数保持不变 C、混合气体的平均摩尔质量不随时间的变化而变化 D、混合气体的的密度不随时间的变化而变化 E、X、Y、Z的浓度之比为1:1:2(4)、当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是。(5)、为使该反应的反应速率增大,可采取的措施是 .
(1)、写出该反应的化学方程式。(2)、计算反应开始到10 s,用X表示的反应速率是 , Y的转化率为。(3)、下列叙述中能说明上述反应达到平衡状态的是____。A、当X与Y的反应速率之比为1:1 B、在混合气体中X的质量百分数保持不变 C、混合气体的平均摩尔质量不随时间的变化而变化 D、混合气体的的密度不随时间的变化而变化 E、X、Y、Z的浓度之比为1:1:2(4)、当反应达到平衡时,用Y表示的正反应速率v(正)与用Z表示的逆反应速率v(逆)的关系是。(5)、为使该反应的反应速率增大,可采取的措施是 .a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
15. 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL某浓度的稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):时间(min)
0
1
2
3
4
5
氢气体积(mL)
0
50
120
232
290
310
(1)、2~3min段的反应速率比1~2min段的反应速率(填“块”或“慢”),原因是;(2)、求2~3min段以HCl的浓度变化来表示的平均反应速率(设溶液体积不变);(3)、如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)____________。A、蒸馏水 B、NaCl溶液 C、Na2CO3溶液 D、CuSO4溶液