高中化学人教版(2019)选择性必修1 第二章第四节 化学反应的调控
试卷更新日期:2020-08-20 类型:同步测试
一、单选题
-
1. 合成氨反应难以发生的根本原因是( )A、该反应是可逆反应 B、氮分子中存在氮氮叁键 C、该反应需要催化剂 D、氨气容易液化2. 比较合成氨工业与制硫酸中SO2催化氧化的生产过程,正确的是( )A、都按化学方程式中的系数比投料 B、都选择了较大的压强 C、使用不同的催化剂加快反应速率 D、都采用吸收剂分离产物3. 合成氨生产中,说法正确的是( )A、使用催化剂,提高原料的利用率 B、采用高温、高压工艺提高氨的产率 C、产物用水吸收,剩余气体循环利用 D、增大反应物浓度,对v正影响更大4. 合成氨工业采用下列措施是为了使平衡正向移动而提高反应物转化率的是( )A、采用高温 B、采用高压 C、使用催化剂 D、以上均不对5. 从化学反应速率和化学平衡两个角度考虑,合成氨应采用的条件是( )A、低温、高压、催化剂 B、低温、低压、催化剂 C、适当温度、高压、催化剂 D、高温、高压、催化剂
二、综合题
-
6. 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1 , 他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。 (1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。(2)、降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。7.(1)、合成氨反应中使用的催化剂是(填名称),该反应温度一般控制在500℃,主要原因是。(2)、下列措施,既能加快合成氨反应的反应速率,又能增大反应物转化率的是(_____)A、使用催化剂 B、缩小容积体积 C、提高反应温度 D、移走NH3(3)、在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件下不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在下图中补充画出从t2到t4时刻正反应速率随时间的变化曲线。
2NH3(g) ΔH=-92.4 kJ·mol-1。 (1)、当反应达到平衡时,N2和H2的浓度比是;N2和H2的转化率比是 . 反应放出的热量(填“大于”“小于”或“等于”)184.8 kJ。(2)、降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 , 密度 . 平衡常数K(填“增大”“减小”或“不变”).(3)、当达到平衡时,充入氩气,并保持压强不变,平衡将(填“正向”“逆向”或“不”)移动.(4)、若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度(填“大于”“小于”或“等于”)原来的2倍。7.(1)、合成氨反应中使用的催化剂是(填名称),该反应温度一般控制在500℃,主要原因是。(2)、下列措施,既能加快合成氨反应的反应速率,又能增大反应物转化率的是(_____)A、使用催化剂 B、缩小容积体积 C、提高反应温度 D、移走NH3(3)、在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件下不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在下图中补充画出从t2到t4时刻正反应速率随时间的变化曲线。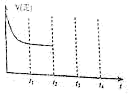 (4)、常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是(________)A、溶液的pH增大 B、氨水的电离程度减小 C、c(NH4+)减小 D、c(OH-)减小(5)、石蕊(用HZ表示)试液中存在的电离平衡HZ(红色) H+ + Z-(蓝色)。通入氨气后石蕊试液呈蓝色,请用平衡移动原理解释。8. 氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g) 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
(4)、常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是(________)A、溶液的pH增大 B、氨水的电离程度减小 C、c(NH4+)减小 D、c(OH-)减小(5)、石蕊(用HZ表示)试液中存在的电离平衡HZ(红色) H+ + Z-(蓝色)。通入氨气后石蕊试液呈蓝色,请用平衡移动原理解释。8. 氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g) 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。 (1)、表示N2浓度变化的曲线是 (填字母),25 min 时c (NH3)=。(2)、0~25min内,用H2 浓度变化表示的化学反应速率是。(3)、此温度下,上述反应的平衡常数K 的数值为。(4)、若升高温度,则平衡向(填“正反应”或“逆反应”)方向移动;正反应速率 (填“增大”“减小”或“不变”,下同 ), 逆反应速率。9. 工业上合成氨反应为:N2+3H2 2NH3 , 回答下列问题:(1)、反应过程中拆开的化学键是;(2)、反应放热,从价键角度分析,反应放热的原因是 , 下列图像正确的是。
(1)、表示N2浓度变化的曲线是 (填字母),25 min 时c (NH3)=。(2)、0~25min内,用H2 浓度变化表示的化学反应速率是。(3)、此温度下,上述反应的平衡常数K 的数值为。(4)、若升高温度,则平衡向(填“正反应”或“逆反应”)方向移动;正反应速率 (填“增大”“减小”或“不变”,下同 ), 逆反应速率。9. 工业上合成氨反应为:N2+3H2 2NH3 , 回答下列问题:(1)、反应过程中拆开的化学键是;(2)、反应放热,从价键角度分析,反应放热的原因是 , 下列图像正确的是。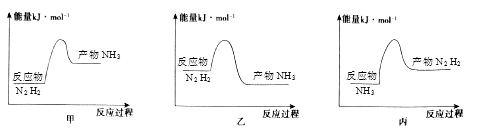 (3)、在体积是2L的密闭容器中开始加入1molN2 , 3molH2 , 反应过程浓度中,物质的浓度与时间的关系如图所示。
(3)、在体积是2L的密闭容器中开始加入1molN2 , 3molH2 , 反应过程浓度中,物质的浓度与时间的关系如图所示。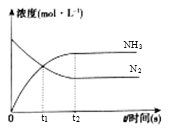
①t1时生成NH3的物质的量是;用H2表示的化学反应速率υ(H2)=。
②下列各项能表明反应达到化学平衡状态的是。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH-H键同时形成6molN-H键
(4)、下列措施中能提高合成氨反应化学反应速率的是。A.使用高效催化剂
B.恒温恒容再充入氢气
C.降低反应温度
D.扩大容器体积
10.氨是重要的化工产品之一,研究合成氨反应具有重要意义.σ
(1)已知断裂下列化学键需要吸收的能量分别为:N≡N 946.0kJ•mol﹣1、H﹣H 436kJ•mol﹣1、N﹣H 390.8kJ•mol﹣1 , 写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式
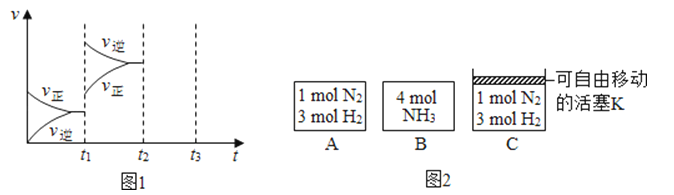
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如图1所示:
①t1时刻改变的条件为
②t2时刻,恒压充入氦气,t3时刻达到平衡.在图中画出t2时刻后的速率变化图象.
(3)相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图2所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡.
①达到平衡时,A、C两个容器中NH3的浓度分别为c1、c2 , 则c1 c2(填“>”、“<”或“=”).
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A)、α(B),则 α(A)+α(B) 1(填“>”、“<”或“=”).
③达到平衡时,若容器C的体积是起始时的 , 则平衡时容器C中H2的体积分数为
(4)直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2═2N2+6H2O,则负极的电极反应式为