山东省临沂市2016-2017学年高一上学期化学期末考试试卷
试卷更新日期:2017-09-23 类型:期末考试
一、选择题
-
1. 化学与生产和生活密切相关.下列叙述错误的是( )A、用食醋可除去热水壶内壁的水垢 B、大量燃烧化石燃料是造成雾霾天气的一种重要因素 C、利用纳米铁粉的物理吸附作用去除水体中的Cu2+、Hg2+等重金属离子 D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”2. 下列与化学概念有关的说法正确的是( )A、Na2O、CaO、Al2O3均为碱性氧化物 B、水玻璃、漂白液、液氯均为混合物 C、氨水能够导电,所以氨水是电解质 D、有单质参加或生成的化学反应不一定是氧化还原反应3. 下列应用涉及氧化还原反应的是( )A、纯碱用于制造玻璃 B、工业上利用合成氨实现人工固氮 C、打磨磁石制指南针 D、医疗上用小苏打治疗胃酸过多4. 下列实验操作正确的是( )A、洗净的容量瓶可以放进烘箱中烘干 B、用磨口玻璃瓶保存NaOH溶液 C、用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口放出 D、用二硫化碳清洗残留在试管壁上少量的硫粉5. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、酸性溶液中:Mg2+、K+、SO42﹣、NO3﹣ B、无色溶液中:Na+、Al3+、NO3﹣、MnO4﹣ C、FeCl溶液中:Na+、NH4+、SCN﹣ , SO42﹣ D、与Al反应放出H2的溶液中:NH4+、Na+、NO3﹣、HCO3﹣6. 下列有关元素及其化合物的叙述正确的是( )A、Fe( OH)3胶体无色、透明,能发生丁达尔现象 B、CO2通入CaCl2溶液中生成CaCO3沉淀 C、将稀硫酸滴加到Fe( NO3)2溶液中无明显现象 D、H2、SO2、CO2三种气体都可以用浓硫酸干燥7. 设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )A、1mol OH﹣所含电子数为10NA B、2L0.5 mol•L﹣1Na2SO4溶液中阴离子所带电荷数为0.2NA C、标准状况下,1.12 L CCl4含有的氯原子数为0.2NA D、14 g由CO和N2组成的混合气体中含有的分子总数为NA8. 下列叙述I和Ⅱ均正确且有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
晶体硅熔点高硬度大
可用于制作半导体材料
B
常温下铁与浓硫酸不反应
可用铁槽车密封运送浓硫酸
C
NH4HCO3受热易分解
可用作氮肥
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A、A B、B C、C D、D9. 下列实验操作或装置(略去部分夹持仪器)正确的是( )A、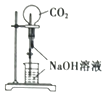 喷泉实验
B、
喷泉实验
B、 配制一定物质的量浓度的NaCl溶液
C、
配制一定物质的量浓度的NaCl溶液
C、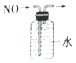 排水法收集NO
D、
排水法收集NO
D、 碳酸氢钠受热分解
10. 下列离子方程式正确的是( )A、向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ B、铜溶于稀硝酸:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O C、向稀硫酸中加入 Ba(OH)2 溶液:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+11. 下列叙述正确的是( )A、Na在空气中久置最终变为NaHCO3粉末 B、向Fe2(SO4)3溶液中加入铜粉,溶液变蓝且有黑色固体析出 C、Cl2能与石灰乳反应,可用于制取漂白粉 D、向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀12. 下列有关实验操作、现象和结论均正确的是( )
碳酸氢钠受热分解
10. 下列离子方程式正确的是( )A、向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ B、铜溶于稀硝酸:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O C、向稀硫酸中加入 Ba(OH)2 溶液:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+11. 下列叙述正确的是( )A、Na在空气中久置最终变为NaHCO3粉末 B、向Fe2(SO4)3溶液中加入铜粉,溶液变蓝且有黑色固体析出 C、Cl2能与石灰乳反应,可用于制取漂白粉 D、向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀12. 下列有关实验操作、现象和结论均正确的是( )选项
实验操作
现象
结论
A
某溶液中滴加足量盐酸酸化的 BaCl2溶液
生成白色沉淀
原溶液中一定含有SO42﹣
B
将Cl2通入石蕊试液中
石蕊试液先变红 后褪色
Cl2具有漂白性
C
用洁净的铂丝蘸取某溶液进行焰色反应实验
火焰呈黄色
原溶液一定含有Na+ , 一定不含K+
有
D
将KI和FeCl3溶液在试管中混 合后,加入CCl4 , 振荡,静置
下层溶液显紫红 色
氧化性Fe3+>I2
A、A B、B C、C D、D13. 在给定条件下,下列选项所示的物质间转化均能一步实现的是(A、S SO3 H2SO4 B、SiO2 SiCl4 Si C、NH3 NO NO2 D、Fe FeCl2 Fe(OH)214. ClO2是一种常用的气体消毒剂,能净化有毒废水中的NaCN (已知NaCN中N的化合价为﹣3),发生的反应为:2ClO2+2NaCN═2NaCl+2CO2+N2 , 下列说法正确的是( )
A、反应中氯元素被氧化 B、NaCN既是氧化剂又是还原剂 C、生成0.1mol N2 , 转移1mol电子 D、氧化产物与还原产物的物质的域之比为1:115. 下列反应中,反应后固体质量减轻的是( )①氨气通过灼热的CuO粉末
②二氧化碳通过Na2O2粉末
③水蒸气通过灼热的Fe粉
④Zn投入CuSO4溶液.
A、①② B、①④ C、②③ D、②④16. CuO和Fe2O3组成的混合物m g,向其中加入100mL0.5mo1•L﹣1的H2SO4液恰好完全反应,若将2m g该混合物用足量CO还原,充分反应后剩余固体的质量为( )A、(2m﹣1.6)g B、(m﹣0.8)g C、(m﹣1.6)g D、(2m﹣0.8)g二、解答题
-
17. 利用元素的化合价推测物质的性质是化学研究的重要手段.
如图是硫元素的常见化合价与部分物质类别的对应关系:
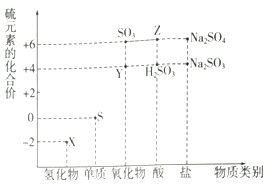 (1)、从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式).(2)、将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为 .(3)、检验物质Y的方法是 .(4)、Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为 .(5)、Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是(填代号).
(1)、从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式).(2)、将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为 .(3)、检验物质Y的方法是 .(4)、Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为 .(5)、Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是(填代号).a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4d.Na2SO3+Na2SO4
(6)、已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05mol•L﹣1的Na2SO3溶液与 20mL 0.02mol•L﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为 .18. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl﹣、SO42﹣中的几种离子.a.取0.1mL该废水于管中,加入足量的Ba(NO3)溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生.
b.另取10mL该废水于管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解.生成沉淀的物质的量随加入NaOH物质的量关系如图所示.
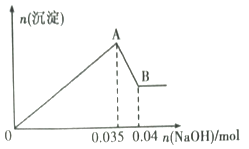
根据上述实验和图表数据:
(1)、该废水中一定不含有的离子有(填离子符号).(2)、实验室配制100mL mol•L﹣1的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称).(3)、写出A→B过程中发生反应的离子方程式: .(4)、该废水中,c(Al3+)= .19. A、B、C、D、E、X是中学化学中的常见物质,存在如图所示转化关系(部分生成物和反应条件略去).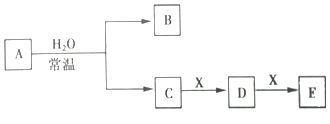 (1)、若A为淡黄色粉末,则0.1molA与水反应时转移的电子数目为 .(2)、若A为常见的金属单质,焰色反应呈黄色;X是一种造成温室效应的气体,则鉴别等浓度的D、E两种溶液的试剂为 .(3)、若B具有漂白性,则A与H2O反应的离子方程式: .(4)、若A为红棕色气体,向E溶液中滴加足量氨水,生成的白色沉淀迅速变成绿色,最终变成红褐色.
(1)、若A为淡黄色粉末,则0.1molA与水反应时转移的电子数目为 .(2)、若A为常见的金属单质,焰色反应呈黄色;X是一种造成温室效应的气体,则鉴别等浓度的D、E两种溶液的试剂为 .(3)、若B具有漂白性,则A与H2O反应的离子方程式: .(4)、若A为红棕色气体,向E溶液中滴加足量氨水,生成的白色沉淀迅速变成绿色,最终变成红褐色.①X的化学式为 .
②A与H2O反应的化学方程式为 .
20. 明矾[KAl(SO4)2]是一复盐,在造纸等方面应用广泛.某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂志)制备明矾的实验方案如图1: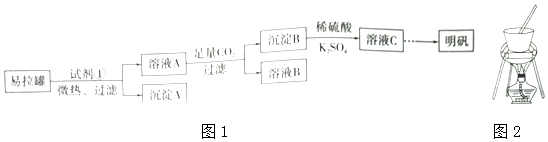 (1)、试剂①应选用(填代号).
(1)、试剂①应选用(填代号).a.盐酸b.H2SO4溶液c.氧水d.NaOH溶液
(2)、易拉罐溶解过程中主要反应的化学方程式为 .(3)、溶液B中溶质的主要成分为(填化学式).(4)、从溶液C中得到明矾的实验操作步骤为蒸发浓缩、(填操作名称)、过滤、洗涤、干燥.如图2所示,蒸发操作中的一处错误是 .(5)、该小组在实验完成之后,得到118.5g明矾,则明矾的回收率为 . (已知:明矾的摩尔质量为474g•mol﹣1)21. 某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.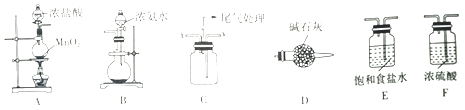 (1)、若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→→B;为使NH3与Cl2更充分混合,Cl2应从C装置的口进入(填“x”或“y”).(2)、简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是 .(3)、装置A中发生反应的离子方程式为 .(4)、装置B中圆底烧瓶内的试剂为(填名称).(5)、装置D的作用是 .(6)、反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为 .
(1)、若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→→B;为使NH3与Cl2更充分混合,Cl2应从C装置的口进入(填“x”或“y”).(2)、简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是 .(3)、装置A中发生反应的离子方程式为 .(4)、装置B中圆底烧瓶内的试剂为(填名称).(5)、装置D的作用是 .(6)、反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为 .