江苏省泰州市2020年中考化学试卷
试卷更新日期:2020-08-17 类型:中考真卷
一、单选题
-
1. 下列变化属于物理变化的是( )A、食物腐败 B、干冰升华 C、光合作用 D、煤气燃烧2. 下列物质属于纯净物的是( )A、雪碧 B、牛奶 C、氧气 D、食醋3. 下列化学用语书写正确的是( )A、氮气N2 B、氯离子Cl1- C、铝元素AL D、1个氢分子2H4. 下列物质用途,主要利用其化学性质的是( )A、用钨制作灯丝 B、用铝制作导线 C、石墨制铅笔芯 D、用焦炭冶炼铁5. 下列实验操作错误的是( )A、取用粉末
 B、蒸发结晶
B、蒸发结晶  C、加热液体
C、加热液体  D、连接仪器
D、连接仪器  6. 下列做法正确的是( )A、工业废气直接排放 B、过度服用维生素C C、大量使用农药化肥 D、生活垃圾分类回收7. 下列物质溶于水,能形成溶液的是( )A、蔗糖 B、泥土 C、粉笔灰 D、食用油8. 制造北斗三号卫星使用了钛合金材料,钛原子的质子数为22,相对原子质量为48,则钛原子的核外电子数为( )A、22 B、48 C、70 D、269. 儿童体内缺少锌元素,严重时易患的疾病是( )A、佝偻病 B、贫血症 C、侏儒症 D、甲状腺疾病10. 下列实验现象描述正确的是( )A、淀粉溶液中滴加碘水,溶液呈红色 B、硫在氧气中燃烧,发岀明亮蓝紫色火焰 C、硬水中滴加肥皂水,产生大量泡沫 D、镁条在空气中燃烧,产生大量黑色固体11. 水杨酸(C7H6O3)能有效抑制葡萄球菌和大肠杄菌。下列有关说法正确的是( )A、水杨酸由三种元素组成 B、水杨酸中氢元素的质量分数最大 C、1个水杨酸分子中含有20个原子 D、水杨酸中氢、氧两种元素的质量比为2:112. 下列说法错误的是( )A、活性炭可用于净水,是因为能吸附水中的杂质 B、洗洁精能洗去油污,是因为洗洁精能溶解油污 C、水和过氧化氢的化学性质不同,是因为它们的分子构成不同 D、铝制品不能用钢丝球擦洗,是因为易破坏表面的致密氧化膜13. 下列有关物质的提纯、分离、鉴别以及检验的做法,正确的是( )A、除去KCl溶液中混有的少量CaCl2:加入过量K2CO3溶液,过滤 B、分离铁粉与铜粉∶加入适量AgNO3溶液,过滤、洗涤、干燥 C、鉴别硫酸溶液与硫酸钠溶液:加入BaCl2溶液 D、检验二氧化硫气体:将气体通入稀高锰酸钾溶液
6. 下列做法正确的是( )A、工业废气直接排放 B、过度服用维生素C C、大量使用农药化肥 D、生活垃圾分类回收7. 下列物质溶于水,能形成溶液的是( )A、蔗糖 B、泥土 C、粉笔灰 D、食用油8. 制造北斗三号卫星使用了钛合金材料,钛原子的质子数为22,相对原子质量为48,则钛原子的核外电子数为( )A、22 B、48 C、70 D、269. 儿童体内缺少锌元素,严重时易患的疾病是( )A、佝偻病 B、贫血症 C、侏儒症 D、甲状腺疾病10. 下列实验现象描述正确的是( )A、淀粉溶液中滴加碘水,溶液呈红色 B、硫在氧气中燃烧,发岀明亮蓝紫色火焰 C、硬水中滴加肥皂水,产生大量泡沫 D、镁条在空气中燃烧,产生大量黑色固体11. 水杨酸(C7H6O3)能有效抑制葡萄球菌和大肠杄菌。下列有关说法正确的是( )A、水杨酸由三种元素组成 B、水杨酸中氢元素的质量分数最大 C、1个水杨酸分子中含有20个原子 D、水杨酸中氢、氧两种元素的质量比为2:112. 下列说法错误的是( )A、活性炭可用于净水,是因为能吸附水中的杂质 B、洗洁精能洗去油污,是因为洗洁精能溶解油污 C、水和过氧化氢的化学性质不同,是因为它们的分子构成不同 D、铝制品不能用钢丝球擦洗,是因为易破坏表面的致密氧化膜13. 下列有关物质的提纯、分离、鉴别以及检验的做法,正确的是( )A、除去KCl溶液中混有的少量CaCl2:加入过量K2CO3溶液,过滤 B、分离铁粉与铜粉∶加入适量AgNO3溶液,过滤、洗涤、干燥 C、鉴别硫酸溶液与硫酸钠溶液:加入BaCl2溶液 D、检验二氧化硫气体:将气体通入稀高锰酸钾溶液二、多选题
-
14. 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
 A、在t2℃时,甲、乙两物质的溶解度相等 B、在t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质甲的质量最大 C、甲中混有少量乙时,宜采用降温结晶的方法提纯甲 D、将t3℃的甲、乙、丙三种物质的饱和溶液降温至t1℃时,只有丙溶液仍是饱和溶液15. 中国科学家以CO2和H2为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是( )
A、在t2℃时,甲、乙两物质的溶解度相等 B、在t1℃时,甲、乙、丙三种物质的饱和溶液中,溶质甲的质量最大 C、甲中混有少量乙时,宜采用降温结晶的方法提纯甲 D、将t3℃的甲、乙、丙三种物质的饱和溶液降温至t1℃时,只有丙溶液仍是饱和溶液15. 中国科学家以CO2和H2为原料,经催化可转化为有机物,其微观反应原理如下图所示。下列说法正确的是( ) A、甲物质的化学式为C4H9 B、反应②属于置换反应 C、催化剂Ⅰ、Ⅱ的质量和化学性质在反应前后均不变 D、反应①的化学方程式为
A、甲物质的化学式为C4H9 B、反应②属于置换反应 C、催化剂Ⅰ、Ⅱ的质量和化学性质在反应前后均不变 D、反应①的化学方程式为三、填空题
-
16. 在抗击新冠肺炎的过程中,测体温,戴口罩、勤消毒等是必需的防疫措施。(1)、水银体温计中的汞是由直接构成;测量体温,汞柱上升,汞微粒之间的增大。(2)、医用防护口罩使用了超细聚丙烯纤维,聚丙烯纤维属于材料;戴口罩能有效阻隔可吸入颗粒物、细菌、病毒等,其阻隔原理与化学实验中的基本操作类似。(3)、免洗手消毒液中含有的酒精,可使细菌中的蛋白质达到消毒目的;由于酒精具有性,开瓶用后应立即拧紧瓶盖,以免浓度降低;酒精使用时应远离火种,酒精不慎泼洒燃烧,灭火的方法是。
四、实验题
-
17. 请回答下列问题:(1)、现提供下列实验仪器和装置:
 ①实验室用高锰酸钾制氧气,反应的化学方程式为;该实验可选用F和(填序号)组装成排水法收集氧气的装置;还可用方法收集氧气。
①实验室用高锰酸钾制氧气,反应的化学方程式为;该实验可选用F和(填序号)组装成排水法收集氧气的装置;还可用方法收集氧气。②实验室用锌粒和稀硫酸制氢气,反应的化学方程式为;为达到控制反应生和停止的目的,发生装置应选择A和(填序号);为除去氢气中的水分,用B、C组装成一套装置,向B中加入液体试剂 , 气体通过此装置达到目的。
(2)、实验室用氯化钠固体配制50g溶质质量分数为15%的氯化钠溶液。①量取水,应选择(填“10mL”或“50mL”)量筒。
②下列操作导致氯化钠溶液的溶质质量分数偏大的是(填序号)。
a.取用潮湿的氯化钠
b称量时,所用砝码表面已生锈
c量取水时仰视读数
d转移溶液后,烧杯内还有少量氯化钠固体
五、推断题
-
18. A~F是初中化学常见物质。A是生命之源,是人体中含量最多的物质;B与A发生化合反应生成C,C俗称熟石灰;D是由三种非金属元素组成的盐,D和A混合,溶液温度显著降低,据此原理可制作“摇摇冰”;C与D混合加热反应生成A、E、F三种物质,E为有刺激性气味的气体。请回答下列问题:(1)、A的化学式为;电解A的实验,正、负极产生的气体体积比为。(2)、B俗称 , B与A反应的化学方程式为。(3)、C的澄清溶液通常用来检验气体。(4)、D在农业上可用作肥。(5)、E能使湿润的红色石蕊试纸变色。(6)、C与D混合加热反应的化学方程式为。
六、科学探究题
-
19. 酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。(1)、(实验探究Ⅰ)在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度 , 由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化。
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化。
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示。
(2)、由图可知,盐酸、氢氧化钠溶液稀释时均(填“放热”或“吸热”),但它们稀释时温度的变化量远两溶液混合时温度的变化量。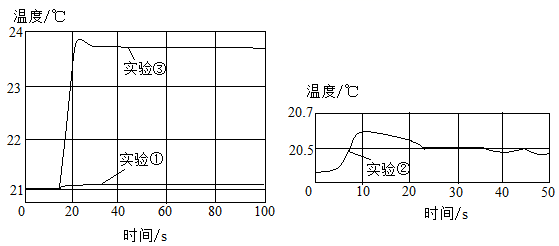 (3)、从微观角度分析,此中和反应的温度变化主要是由于(填离子符号)两种离子发生反应放出热量的缘故。(4)、(实验探究Ⅱ)
(3)、从微观角度分析,此中和反应的温度变化主要是由于(填离子符号)两种离子发生反应放出热量的缘故。(4)、(实验探究Ⅱ)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。该反应的化学方程式为。
(5)、取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们对红色溶液中溶质的成分(酚酞除外)进行再探究。查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色。
作出猜想:猜想一:NaCl
猜想二:NaCl、NaOH
猜想三:NaCl、NaOH和Na2CO3
同学们讨论后一致认为猜想是错误的,理由是。
实验验证:取样,滴加 , 无气泡产生,猜想三不正确。
原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在范围内,溶液的颜色变红。
总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色(填“一定”或“不一定”)变红。
七、流程题
-
20. 硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如下图所示。请回答下列问题:
 (1)、B2O3中B元素的化合价为。(2)、为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是;回收副产物Mg(OH)2可制得流程的反应物。(3)、H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为。(4)、根据流程③的化学反应方程式: ,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
(1)、B2O3中B元素的化合价为。(2)、为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是;回收副产物Mg(OH)2可制得流程的反应物。(3)、H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为。(4)、根据流程③的化学反应方程式: ,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
-
-
-
-