高中化学人教版(新课标)选修4 第一章测试卷
试卷更新日期:2020-08-11 类型:单元试卷
一、单选题
-
1. 下列有关能源的说法不正确的是( )A、人类在远古时代就通过燃烧植物的方式开始利用生物质能 B、氢能是理想的绿色能源,但人们只能将氢气的化学能转化为热能 C、煤中含有硫元素,大量的直接燃烧煤会引起酸雨等环境问题 D、太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热2. 下列装置能达到实验目的的是( )A、熔化Na2CO3
 B、保存液溴
B、保存液溴  C、分液,先放出水层,再倒出溴的苯溶液
C、分液,先放出水层,再倒出溴的苯溶液  D、进行中和热的测定
D、进行中和热的测定  3. 下列物质间的反应,其能量变化符合如图的是( )
3. 下列物质间的反应,其能量变化符合如图的是( )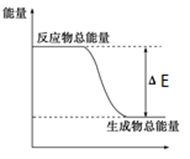 A、碳酸钙的分解 B、灼热的炭与二氧化碳反应 C、Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D、钠和水反应4. 理论研究表明,在101kPa和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是( )
A、碳酸钙的分解 B、灼热的炭与二氧化碳反应 C、Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D、钠和水反应4. 理论研究表明,在101kPa和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是( ) A、HCN比HNC稳定 B、该异构化反应的 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热5. 用 NA 表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 L NO 和 22.4 L O2 混合后的分子总数为 2 NA B、0.1mol•L-1 的氨水中,溶液中各微粒的物质的量存在以下关系: n(NH 4+)+n(NH3)+n(NH •H2O)=0.1 mol C、已知氢气的热值为 143kJ•g-1 , 则氢气充分燃烧的热化学方程式可表示为: H2(g)+ O2(g)= H2O(l) ΔH=-286 kJ•mol −1 D、用酸性高锰酸钾溶液检验火柴头燃烧产生的 SO2 气体,当 10mL0.1mol•L-1 的酸性高锰酸钾溶液刚好褪色时,转移的电子总数为 0.0025NA6. H2 和 I2 在一定条件下能发生反应:H2(g) +I2(g) 2HI(g) △H= -a kJ/mol
A、HCN比HNC稳定 B、该异构化反应的 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热5. 用 NA 表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 L NO 和 22.4 L O2 混合后的分子总数为 2 NA B、0.1mol•L-1 的氨水中,溶液中各微粒的物质的量存在以下关系: n(NH 4+)+n(NH3)+n(NH •H2O)=0.1 mol C、已知氢气的热值为 143kJ•g-1 , 则氢气充分燃烧的热化学方程式可表示为: H2(g)+ O2(g)= H2O(l) ΔH=-286 kJ•mol −1 D、用酸性高锰酸钾溶液检验火柴头燃烧产生的 SO2 气体,当 10mL0.1mol•L-1 的酸性高锰酸钾溶液刚好褪色时,转移的电子总数为 0.0025NA6. H2 和 I2 在一定条件下能发生反应:H2(g) +I2(g) 2HI(g) △H= -a kJ/mol已知:
 (a、b、c 均大于零)
(a、b、c 均大于零)下列说法正确的是( )
A、碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞 B、断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ C、相同条件下,1 mol H2 (g)和 1mol I2 (g)总能量小于 2 mol HI (g)的总能量 D、向密闭容器中加入 2 mol H2 (g)和 2 mol I2 (g),充分反应后放出的热量为 2a kJ7. 下列说法或表示法不正确的是( )A、1mol硫蒸气与2mol硫蒸气完全燃烧时,燃烧热相同 B、已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 , 则H2的燃烧热为285.8kJ·mol-1 C、在稀溶液中:H+(aq)+OH-(aq)=H2O(aq)△H=-57.3kJ·mol-1 , 若将含1molCH3COOH的稀醋酸溶液与含1molBa(OH)2的稀溶液混合,放出的热量小于57.3kJ D、已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol;Ⅱ: ,
,  ,且a、b、c均大于零,则断开1mol H-Cl键所需的能量为2(a-b-c) kJ/mol
8. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得较高反应速率,反应过程如图:
,且a、b、c均大于零,则断开1mol H-Cl键所需的能量为2(a-b-c) kJ/mol
8. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得较高反应速率,反应过程如图:
下列说法正确的是( )
A、若已知CO和H2的标准燃烧热,由此可推算出该反应的ΔH B、过程Ⅰ、过程Ⅱ均为吸热过程,且吸收的热量相等 C、在该反应过程中,实际有两个H2O参与反应,断裂了三个氢氧键 D、使用催化剂降低了水煤气变换反应的ΔH , 提高了反应速率9. 已知下列反应的反应热:⑴CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)ΔH1=-870.3 kJ·mol-1
⑵C(s)+O2(g)=CO2(g)ΔH2=-393.5 kJ·mol-1
⑶H2(g)+1/2O2(g)=H2O(l)ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A、ΔH=-488.3 kJ·mol-1 B、ΔH=-244.15 kJ·mol-1 C、ΔH=-977.6 kJ·mol-1 D、ΔH=+488.3 kJ·mol-110. 在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和热。下列关于该实验的说法正确的是( ) A、从实验装置看(量筒未画出),图中还缺少一个重要的仪器 B、做完一次完整的中和热测定实验,温度计需要使用2次 C、烧杯间的碎纸屑的作用是固定烧杯的位置 D、由于实验过程中有热量的散失,所以测得的中和热△H比理论值要小11. 在25℃、100 kPa时,已知:
A、从实验装置看(量筒未画出),图中还缺少一个重要的仪器 B、做完一次完整的中和热测定实验,温度计需要使用2次 C、烧杯间的碎纸屑的作用是固定烧杯的位置 D、由于实验过程中有热量的散失,所以测得的中和热△H比理论值要小11. 在25℃、100 kPa时,已知:①2H2O(g) = O2(g)+2H2(g) ΔH1
②Cl2(g)+H2(g) = 2HCl(g) ΔH2
③2Cl2(g)+2H2O(g) = 4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1、ΔH2间的关系正确的是 ( )
A、ΔH3 = ΔH1+2ΔH2 B、ΔH3 = ΔH1+ΔH2 C、ΔH3 = ΔH1—2ΔH2 D、ΔH3 = ΔH1—ΔH212. 下列依据热化学方程式得出的结论正确的是( )A、已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ·mol-1 , 则氢气的燃烧热为241.8kJ·mol-1 B、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3kJ· mol-1 , 则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出大于28.65kJ的热量 C、已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 D、已知2C(s)+2O2(g)=2CO2(g) △H=a、2C(s)+O2(g)=2CO(g) △H=b,则a>b二、填空题
-
13. 在101 kPa时,氢气在1.0 mol氧气中完全燃烧,生成2.0 mol液态水,放出571.6 kJ的热量,氢气的标准燃烧热ΔH为 , 表示氢气标准燃烧热的热化学方程式为14. CH4的燃烧热为893 kJ·mol-1 , 写出表示甲烷燃烧热的热化学方程式:。15. 根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
N2(g)+3H2O(l)=2NH3(g)+1.5O2(g),△H.
已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol,
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol,
则N2(g)+3H2O(l)=2NH3(g)+1.5O2(g)的△H=kJ/mol(用含a、b的式子表示).
三、综合题
-
16. 2SO2(g)+O2(g) ) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
 (1)、图中A、C分别表示: 、 , E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是 。(2)、图中ΔH=kJ/mol。(3)、已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成2 mol SO3(g)ΔH=17. 已知下列热化学方程式:
(1)、图中A、C分别表示: 、 , E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是 。(2)、图中ΔH=kJ/mol。(3)、已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成2 mol SO3(g)ΔH=17. 已知下列热化学方程式:①H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)、上述反应中属于放热反应的是。(2)、H2的燃烧热为 , C的燃烧热为。(3)、燃烧10 g H2生成液态水,放出的热量为。(4)、CO的燃烧热为 , 其热化学方程式为。18. 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题: (1)、从实验装置上看,图中尚缺少的一种玻璃仪器是 .(2)、大烧杯上如果不盖硬纸板,求得的中和热数值(填“偏 大”,“偏小”或“无影响”).(3)、实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”“不相等”),简述理由: .(4)、若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为: ①3.2℃ ②2.2℃ ③3.0℃写出表示盐酸与NaOH溶液反应的中和热的热化学方程式 .
(1)、从实验装置上看,图中尚缺少的一种玻璃仪器是 .(2)、大烧杯上如果不盖硬纸板,求得的中和热数值(填“偏 大”,“偏小”或“无影响”).(3)、实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”“不相等”),简述理由: .(4)、若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为: ①3.2℃ ②2.2℃ ③3.0℃写出表示盐酸与NaOH溶液反应的中和热的热化学方程式 .(小数点后保留一位小数)
19. 已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
试回答:
(1)、CO的燃烧热ΔH=。(2)、在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为(3)、工业废气中的CO2可用碱液吸收。所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1
CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-b kJ·mol-1
则:①反应CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
②标况下,11.2 L CO2与足量的NaOH溶液充分反应后,放出的热量为 kJ(用含a或b的代数式表示)。
20. 研究 氧化 制 对资源综合利用有重要意义。相关的主要化学反应有:Ⅰ
Ⅱ
Ⅲ
Ⅳ
已知: 时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的 ( 随温度变化可忽略)。例如: 。
请回答:
(1)、①根据相关物质的相对能量计算 。②下列描述正确的是
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下: ,且第二步速率较慢(反应活化能为 )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从 的能量 ,开始(如图2)
。
 (2)、① 和 按物质的量1:1投料,在 和保持总压恒定的条件下,研究催化剂X对“ 氧化 制 ”的影响,所得实验数据如下表:
(2)、① 和 按物质的量1:1投料,在 和保持总压恒定的条件下,研究催化剂X对“ 氧化 制 ”的影响,所得实验数据如下表:催化剂
转化率
转化率
产率
催化剂X
19.0
37.6
3.3
结合具体反应分析,在催化剂X作用下, 氧化 的主要产物是 , 判断依据是。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高 的选择性(生成 的物质的量与消耗 的物质的量之比)。在 ,乙烷平衡转化率为 ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到 。结合具体反应说明乙烷转化率增大的原因是。