高中化学人教版(新课标)选修4 第一章第一节 化学反应与能量变化
试卷更新日期:2020-08-11 类型:同步测试
一、单选题
-
1. 有关化学反应中的能量变化,下列叙述正确的是( )A、酸碱中和反应是吸热反应 B、反应过程中化学键的断裂释放能量 C、反应过程中化学键的形成释放能量 D、将Ba(OH)2·8H2O晶体与NH4Cl晶体的混合搅拌会放出大量热2. 下列反应过程中的能量变化与图一致的是( )
 A、2H2O
A、2H2O 2H2↑ + O2↑
B、在加热条件下氢气还原氧化铜
C、胆矾受热分解
D、铝热反应
3. 关于下列 的判断正确的是( )A、 B、 C、 D、4. 已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )A、X的能量一定高于M B、Y的能量一定高于N C、X和Y的总能量一定高于M和N的总能量 D、因该反应为放热反应,故不必加热就可发生反应5. 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1 , 下列说法错误的是( )A、CO(g)+ O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1 B、2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ C、相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 D、拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量6. 已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是( )
2H2↑ + O2↑
B、在加热条件下氢气还原氧化铜
C、胆矾受热分解
D、铝热反应
3. 关于下列 的判断正确的是( )A、 B、 C、 D、4. 已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )A、X的能量一定高于M B、Y的能量一定高于N C、X和Y的总能量一定高于M和N的总能量 D、因该反应为放热反应,故不必加热就可发生反应5. 已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1 , 下列说法错误的是( )A、CO(g)+ O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1 B、2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ C、相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 D、拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量6. 已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是( ) A、ΔH2=ΔH1+ΔH3 B、断裂1molO2(g)中的共价键需要吸收500kJ的能量 C、ΔH2>ΔH1 D、N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-17. 与反应C+CO2 2CO-Q相符的示意图有( )
A、ΔH2=ΔH1+ΔH3 B、断裂1molO2(g)中的共价键需要吸收500kJ的能量 C、ΔH2>ΔH1 D、N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-17. 与反应C+CO2 2CO-Q相符的示意图有( )


 A、① B、②④ C、③ D、①③8. 下列变化过程吸热的有多少个( )
A、① B、②④ C、③ D、①③8. 下列变化过程吸热的有多少个( )①Ba(OH)2·8H2O与NH4Cl晶体混合搅拌;②盐酸和氢氧化钠溶液混合;③硫受热融化;④石灰石高温分解;⑤碳和氧气反应生成一氧化碳;⑥生石灰和水反应生成熟石灰;⑦镁条在氮气中燃烧;⑧碳在高温下和水蒸气反应生成水煤气;⑨水蒸气液化
A、4个 B、5个 C、6个 D、7个9. 乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是( )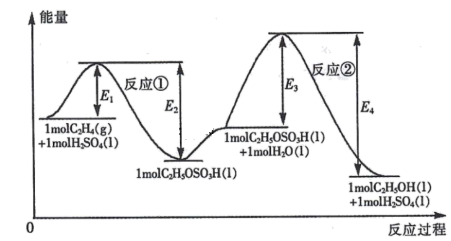 A、H2SO4是该合成过程的催化剂 B、合成过程的速率由反应②决定 C、反应①和反应②均为放热反应 D、C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ• mol-110. 25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )A、2H2(g)+O2(g) = 2H2O(1) △H= -285.8kJ/mol B、2H2(g)+ O2(g) = 2H2O(1) △H= +571.6 kJ/mol C、2H2(g)+O2(g) = 2H2O(g) △H= -571.6 kJ/mol D、H2(g)+1/2O2(g) = H2O(1) △H= -285.8kJ/mol
A、H2SO4是该合成过程的催化剂 B、合成过程的速率由反应②决定 C、反应①和反应②均为放热反应 D、C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ• mol-110. 25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )A、2H2(g)+O2(g) = 2H2O(1) △H= -285.8kJ/mol B、2H2(g)+ O2(g) = 2H2O(1) △H= +571.6 kJ/mol C、2H2(g)+O2(g) = 2H2O(g) △H= -571.6 kJ/mol D、H2(g)+1/2O2(g) = H2O(1) △H= -285.8kJ/mol二、综合题
-
11. 25mL 0.5mol/L的硫酸与50mL 0.55mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。请回答下列问题:
 (1)、从实验装置上看,图中尚缺少的一种玻璃用品是;
(1)、从实验装置上看,图中尚缺少的一种玻璃用品是;由图可知该装置有不妥之处,应如何改进?。
(2)、若量取碱的时候仰视读数,则求得的中和热△H(填“偏大”、“偏小’、“无影响”下同) 。若用相同浓度和体积的氨水代替NaOH进行上述实验,测得中和热△H。(3)、设混合溶液的比热容为c kJ/(g.℃) .硫酸和NaOH溶液的密度认为都是1g·cm-3 , 若实验过程中,测得硫酸和NaOH溶液的起始温度的平均值为T1℃。溶液混合后的最高温度为T2℃,试写出该实验中,中和热表达式△H=。(化成最简式)12. 某化学兴趣小组要完成中和热的测定。(1)、实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是、。(2)、实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。(3)、他们记录的实验数据如表:实验用品
溶液温度
中和热
t1
t2
ΔH
①
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.3 ℃
②
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
(4)、若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。
三、计算题
-
13. 溶液与 锌粉在量热计中充分反应。测得反应前温度为 ,反应后最高温度为 。
已知:反应前后,溶液的比热容均近似为 、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)、反应放出的热量 J。(2)、反应 的 (列式计算)。