高中化学人教版(新课标)必修1 第二章第二节 离子反应
试卷更新日期:2020-08-11 类型:同步测试
一、单选题
-
1. 下列既不属于电解质,又不属于非电解质的是( )A、Cl2 B、CH3OH C、Ca(OH)2 D、BaSO42. 下列关于电解质、非电解质的说法正确的是( )A、氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 B、CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质 C、导电能力弱的溶液肯定是弱电解质的溶液 D、HF的水溶液中既有H+、F- , 又有大量的HF分子,因此HF是弱电解质3. 下列各组离子在水溶液中能大量共存的是( )A、 、Cl-、OH- B、Ba2+、H+、 C、Mg2+、K+、OH- D、K+、Na+、4. 检验某溶液X中是否含有 Na+、K+、Fe3+、Mg2+、Iˉ、Cl-、CO32ˉ、SO42ˉ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是 ( )
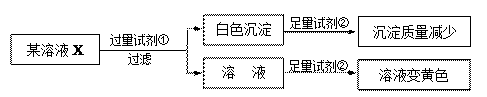 A、溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ B、通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- C、试剂①为硝酸钡溶液 D、通过焰色反应,可确认溶液X中阳离子的种类5. 有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42- , 现将此溶液分成三等份,进行如下实验:
A、溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ B、通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- C、试剂①为硝酸钡溶液 D、通过焰色反应,可确认溶液X中阳离子的种类5. 有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42- , 现将此溶液分成三等份,进行如下实验:⑴向第一份中加入AgNO3溶液,有沉淀产生;
⑵向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
⑶向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是( )
A、K+不一定存在 B、Ba2+、Mg2+不一定都存在 C、Cl-不一定存在 D、混合溶液中CO32-的浓度为0.2 mol/L6. 有NaCl、FeCl2、FeCl3、MgCl2、AlCl3这五种溶液,只用一种试剂就可以把它们鉴别出来,这种试剂是( )A、烧碱溶液 B、KSCN试剂 C、氨水 D、盐酸7. 下列指定反应的离子方程式正确的是( )A、Cl2通入水中制氯水: B、NO2通入水中制硝酸: C、 NaAlO2溶液中通入过量CO2: D、 AgNO3溶液中加入过量浓氨水:8. 向H2SO4和NH4Al(SO4)2的混合溶液中滴加NaOH溶液,不可能发生( )A、H++OH-→H2O B、Al3++4NH3·H2O→AlO2-+4NH4++2H2O C、NH4++OH-→NH3·H2O D、Al(OH)3+OH-→AlO2-+2H2O9. 下列离子方程式中,只能表示唯一一个酸碱中和反应的是( )A、H++NH3·H2O=NH4++H2O B、CH3COOH+OH-=CH3COO-+H2O C、2H++Mg(OH)2=2H2O+Mg2+ D、2H++Ba2++2OH-+SO42-=2H2O+BaSO4↓二、填空题
-
10. 写出下列物质的电离方程式
Na2SO4:
Ba(OH)2:
H2SO4:;
11. 书写下列反应的离子方程式①NaOH溶液和H2SO4溶液:;
②NaCl溶液和AgNO3溶液:;
③Ba(OH)2溶液和H2SO4溶液:;
④Fe与CuSO4溶液反应:;
⑤Na2CO3溶液与Ca(OH)2溶液反应:。
12. 根据条件写出有关反应方程式:(1)、石灰水吸收过量CO2的离子反应方程式:(2)、CuSO4溶液检验H2S气体的离子反应方程式:(3)、制备氢氧化铁胶体的化学方程式:(4)、过量的KHCO3与少量石灰乳反应的离子方程式:(5)、稀盐酸除去铜绿[Cu2(OH)2CO3]的化学方程式:三、综合题
-
13. 现有下列六种物质:①Al②熔融KHSO4 ③Ba(OH)2固体④CO2 ⑤盐酸⑥Fe(OH)3胶体,请回答下列问题。(1)、上述物质中,属于强碱的是(填写物质的序号,下同),属于非电解质的是。在题中状态下既是电解质又能导电的是。(2)、①投入③的溶液中反应的离子方程式为。(3)、对物质⑥进行通电,观察到与电源负极相连的电极附近的现象是 , 可证明Fe(OH)3胶粒带电荷(填“ 正 ”或“ 负 ”) 。(4)、写出②在该状态下的电离方程式为。(5)、在③的水溶液中通入过量的④,请写出该反应的离子方程式为。14. 1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子
H+、Mg2+、Al3+、NH4+
可能大量含有的阴离子
Cl-、CO32-
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
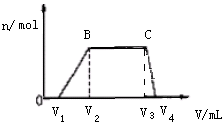 (1)、该溶液中一定不含有的离子是。(2)、V1、V2、V3、V4之间的关系。(3)、V3V4段离子方程式为。15. 有一包白色固体,可能含有Na2CO3、KNO3、KCl、BaCl2和CuSO4 , 按下列步骤实验。
(1)、该溶液中一定不含有的离子是。(2)、V1、V2、V3、V4之间的关系。(3)、V3V4段离子方程式为。15. 有一包白色固体,可能含有Na2CO3、KNO3、KCl、BaCl2和CuSO4 , 按下列步骤实验。①将该固体溶于水得无色溶液。
②向溶液中加入AgNO3溶液,得到白色沉淀,再加足量的稀HNO3 , 白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。根据上述现象判断:
(1)、一定存在的物质是;一定不存在的物质是;可能存在的物质是;(2)、请写出白色沉淀部分溶解的化学方程式