浙江省绍兴市2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2020-08-07 类型:期末考试
一、选择题
-
1. 下列固体中,属于原子晶体的共价化合物是( )A、NaCl B、Si C、SiO2 D、CH3COOH2. 蒸馏含有Fe3+的自来水获得少量纯净的水,需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列属于酸,又是强电解质的是( )A、蔗糖 B、醋酸 C、硫酸 D、稀盐酸4. 反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O中,氧化产物是( )A、H2SO4 B、CuSO4 C、SO2 D、H2O5. 下列物质的名称不正确的是( )A、Na2CO3:纯碱 B、KAl(SO4)2·12H2O:明矾 C、CH2Cl2:氯仿 D、
3. 下列属于酸,又是强电解质的是( )A、蔗糖 B、醋酸 C、硫酸 D、稀盐酸4. 反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O中,氧化产物是( )A、H2SO4 B、CuSO4 C、SO2 D、H2O5. 下列物质的名称不正确的是( )A、Na2CO3:纯碱 B、KAl(SO4)2·12H2O:明矾 C、CH2Cl2:氯仿 D、 :2-甲基戊烷
6. 下列表示正确的是( )A、NaCl的电子式:
:2-甲基戊烷
6. 下列表示正确的是( )A、NaCl的电子式: B、乙醛的结构简式:CH3COH
C、乙烷的比例模型:
B、乙醛的结构简式:CH3COH
C、乙烷的比例模型:  D、二氧化碳的结构式:O=C=O
7. 下列说法不正确的是( )A、气、氘、氚是氢元素的三种核素 B、氧气和臭氧互为同素异形体 C、C5H12的同分异构体有3种,其沸点各不相同 D、乙醇和甘油具有相同的官能团,互为同系物8. 下列说法不正确的是( )A、氧化铝常用于制造耐火材料 B、热的纯碱溶液可以去除物品表面的油污 C、氢气是一种理想的一次能源 D、84消毒液是一种以次氯酸钠为主要成分的消毒剂9. 下列说法不正确的是( )A、工业上用氢气还原氧化铁的方法冶炼铁 B、工业上用焦炭在高温下还原二氧化硅制得粗硅 C、工业上用电解饱和食盐水的方法制备氯气 D、工业上主要采用接触法制硫酸10. 下列说法不正确的是( )A、天然气是有机化合物,煤是无机化合物 B、石油的裂化是为了提高汽油等轻质油的产量和质量 C、煤的气化、液化和干馏都是化学变化 D、在催化剂作用下,用玉米、高粱为原料经水解和发酵可制得乙醇11. 下列有关实验说法,不正确的是( )A、热溶液需冷却后才能转移到容量瓶中 B、可用无水乙醇萃取溴水中的溴单质 C、在闻气体的气味时,应用手轻轻地在集气瓶口扇动,使极少量气体飘进鼻孔 D、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却静置过夜12. 下列关于氮及其化合物说法,不正确的是( )A、工业上可用液氨作制冷剂 B、铵态氮肥应避免与碱性肥料混合使用 C、NO、NO2均为大气污染气体,在大气中可稳定存在 D、工业浓硝酸常因溶有NO2而略显黄色13. 能正确表示下列变化的离子方程式是( )A、CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- B、用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO2-+H2↑ C、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ D、NaHSO4溶液中滴加Ba(OH)2至恰好完全沉淀:H++SO42-+Ba²++OH-=BaSO4↓+H2O14. 下列说法正确的是( )A、玉米油的主要成分是高级脂肪酸甘油酯,是高分子化合物 B、除去溴苯中少量溴,可加NaOH溶液充分振荡后分液 C、向鸡蛋清的溶液中加入饱和硫酸铵溶液产生沉淀,加水后沉淀不溶解 D、淀粉溶液中加入稀硫酸,加热4-5min,在水解液中加入新制氢氧化铜悬浊液加热,可检验淀粉的水解产物15. 下列关于
D、二氧化碳的结构式:O=C=O
7. 下列说法不正确的是( )A、气、氘、氚是氢元素的三种核素 B、氧气和臭氧互为同素异形体 C、C5H12的同分异构体有3种,其沸点各不相同 D、乙醇和甘油具有相同的官能团,互为同系物8. 下列说法不正确的是( )A、氧化铝常用于制造耐火材料 B、热的纯碱溶液可以去除物品表面的油污 C、氢气是一种理想的一次能源 D、84消毒液是一种以次氯酸钠为主要成分的消毒剂9. 下列说法不正确的是( )A、工业上用氢气还原氧化铁的方法冶炼铁 B、工业上用焦炭在高温下还原二氧化硅制得粗硅 C、工业上用电解饱和食盐水的方法制备氯气 D、工业上主要采用接触法制硫酸10. 下列说法不正确的是( )A、天然气是有机化合物,煤是无机化合物 B、石油的裂化是为了提高汽油等轻质油的产量和质量 C、煤的气化、液化和干馏都是化学变化 D、在催化剂作用下,用玉米、高粱为原料经水解和发酵可制得乙醇11. 下列有关实验说法,不正确的是( )A、热溶液需冷却后才能转移到容量瓶中 B、可用无水乙醇萃取溴水中的溴单质 C、在闻气体的气味时,应用手轻轻地在集气瓶口扇动,使极少量气体飘进鼻孔 D、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却静置过夜12. 下列关于氮及其化合物说法,不正确的是( )A、工业上可用液氨作制冷剂 B、铵态氮肥应避免与碱性肥料混合使用 C、NO、NO2均为大气污染气体,在大气中可稳定存在 D、工业浓硝酸常因溶有NO2而略显黄色13. 能正确表示下列变化的离子方程式是( )A、CO32-的水解方程式:CO32-+2H2O H2CO3+2OH- B、用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO2-+H2↑ C、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ D、NaHSO4溶液中滴加Ba(OH)2至恰好完全沉淀:H++SO42-+Ba²++OH-=BaSO4↓+H2O14. 下列说法正确的是( )A、玉米油的主要成分是高级脂肪酸甘油酯,是高分子化合物 B、除去溴苯中少量溴,可加NaOH溶液充分振荡后分液 C、向鸡蛋清的溶液中加入饱和硫酸铵溶液产生沉淀,加水后沉淀不溶解 D、淀粉溶液中加入稀硫酸,加热4-5min,在水解液中加入新制氢氧化铜悬浊液加热,可检验淀粉的水解产物15. 下列关于 的说法,不正确的是( ) A、该物质含有1个手性碳原子 B、该物质可由两种单体分子通过缩聚反应生成 C、该物质在酸性条件下水解产物之一可用于制备阿司匹林 D、1mol该物质与足量NaOH溶液反应,最多可消耗3n molNaOH16. W、X、Y、Z四种元素在周期表中的位置如右图所示,其中W、X、Y为短周期元素,W元素原子核外M层电子数是K层的3倍。下列说法不正确的是( )
的说法,不正确的是( ) A、该物质含有1个手性碳原子 B、该物质可由两种单体分子通过缩聚反应生成 C、该物质在酸性条件下水解产物之一可用于制备阿司匹林 D、1mol该物质与足量NaOH溶液反应,最多可消耗3n molNaOH16. W、X、Y、Z四种元素在周期表中的位置如右图所示,其中W、X、Y为短周期元素,W元素原子核外M层电子数是K层的3倍。下列说法不正确的是( ) A、W的原子半径大于Y B、W的最高价氧化物的水化物酸性小于Y C、X的非金属性比W的强,所以X氢化物的沸点更高 D、Z与Y元素可形成化合物ZY417. 下列说法不正确的是( )A、某溶液c(H+)>c(OH-),则该溶液一定显酸性 B、0.1mol·L-1一元酸HX溶液pH=3,则HX一定为弱电解质 C、相同温度下,等浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大 D、相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-) =c(CH3COO-)18. 液体燃料电池相比于气体燃料电池具有体积小等优点:一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
A、W的原子半径大于Y B、W的最高价氧化物的水化物酸性小于Y C、X的非金属性比W的强,所以X氢化物的沸点更高 D、Z与Y元素可形成化合物ZY417. 下列说法不正确的是( )A、某溶液c(H+)>c(OH-),则该溶液一定显酸性 B、0.1mol·L-1一元酸HX溶液pH=3,则HX一定为弱电解质 C、相同温度下,等浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大 D、相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-) =c(CH3COO-)18. 液体燃料电池相比于气体燃料电池具有体积小等优点:一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )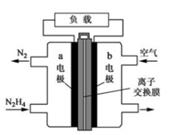 A、b极发生氧化反应 B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C、放电时,电子从b极经过负载流向a极 D、其中的离子交换膜需选用阳离子交换膜19. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g) △H。230℃时,该反应的平衡常数K=2×10-5 , 已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
A、b极发生氧化反应 B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O C、放电时,电子从b极经过负载流向a极 D、其中的离子交换膜需选用阳离子交换膜19. 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g) △H。230℃时,该反应的平衡常数K=2×10-5 , 已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍,下列判断不正确的是( )
A、Ni(s)+4CO(g) Ni(CO)4(g)能自发进行的原因是△H<0 B、增加c(CO),有利于粗镍转化为Ni(CO)4 C、第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ D、第二阶段,Ni(CO)4分解率较低20. NA为阿伏加德罗常数的值,下列说法正确的是( )A、H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1 , 则氨水与盐酸反应生成1molH2O(I) 放热57.3kJ B、S2O32-+2H+=S↓+SO2↑+H2O,则每生成22.4LSO2转移电子数为2NA C、14g乙烯和丙烯的混合物完全燃烧时,产生CO2分子数为NA D、1molCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为2NA21. 温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)=2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:温度/K
t/min
n/mol
t1
t2
t3
t4
T1
n(Y)
0.14
0.12
0.10
0.10
T2
n(Y)
0.13
0.09
0.08
下列说法正确的是( )
A、该反应的正反应为放热反应 B、温度为T1时,0~t1时间段用Z表示的平均反应速率为 molL-1·min-1 C、温度为T2时,t3时刻刚好达到平衡状态 D、在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数不变22. 2SO2(g)+O2(g) 2SO3(g) △H1反应过程中的能量变化如图所示。下列有关叙述不正确的是( ) A、2SO2(g) +O2(g) 2SO3(l) △H2>△H1 B、温度升高,逆反应速率加快幅度大于正反应加快幅度 C、该反应的正反应为放热反应,△H=(E1-E2) Kj·mol-1 D、使用催化剂可降低活化能,提高活化分子百分数23. 室温下,用0.1000mol·L-1的标准盐酸分别滴定20.00mL的0.1000mol·L-1氨水和20.00mL的0.1000mol·L-1氢氧化钠溶液,滴定过程中溶液pH随中和百分数的变化如图所示,已知lg2=0.3,甲基红是一种酸碱指示剂,变色范围为44~6.2。下列有关滴定过程说法不正确的是( )
A、2SO2(g) +O2(g) 2SO3(l) △H2>△H1 B、温度升高,逆反应速率加快幅度大于正反应加快幅度 C、该反应的正反应为放热反应,△H=(E1-E2) Kj·mol-1 D、使用催化剂可降低活化能,提高活化分子百分数23. 室温下,用0.1000mol·L-1的标准盐酸分别滴定20.00mL的0.1000mol·L-1氨水和20.00mL的0.1000mol·L-1氢氧化钠溶液,滴定过程中溶液pH随中和百分数的变化如图所示,已知lg2=0.3,甲基红是一种酸碱指示剂,变色范围为44~6.2。下列有关滴定过程说法不正确的是( ) A、滴定氨水溶液当中和百分数为50%时,各离子浓度间存在关系:c(NH4+)+c(H+) =c(OH-) +c(Cl-) B、滴定氨水溶液中和百分数为100%时,溶液中水的电离程度最大 C、从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳 D、滴定氢氧化钠溶液当中和百分数为150%时,所得溶液的pH=1.724. CaCl2固体遇NH3会形成CaCl2·8NH3。下列说法不正确的是( )A、CaCl2不能用于干燥NH3 B、CaCl2·8NH3中CaCl2与NH3通过分子间作用力结合而成 C、CaCl2·8NH3溶于水,通入少量CO2可产生白色沉淀 D、CaCl2与NH3形成CaCl2·8NH3的过程属于化学变化25. 某固体混合物X,可能含有K2SO3、KAlO2、FeCl3、Na2CO3中的一种或几种。为确定该固体粉末的成分,现取X进行如下实验:
A、滴定氨水溶液当中和百分数为50%时,各离子浓度间存在关系:c(NH4+)+c(H+) =c(OH-) +c(Cl-) B、滴定氨水溶液中和百分数为100%时,溶液中水的电离程度最大 C、从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳 D、滴定氢氧化钠溶液当中和百分数为150%时,所得溶液的pH=1.724. CaCl2固体遇NH3会形成CaCl2·8NH3。下列说法不正确的是( )A、CaCl2不能用于干燥NH3 B、CaCl2·8NH3中CaCl2与NH3通过分子间作用力结合而成 C、CaCl2·8NH3溶于水,通入少量CO2可产生白色沉淀 D、CaCl2与NH3形成CaCl2·8NH3的过程属于化学变化25. 某固体混合物X,可能含有K2SO3、KAlO2、FeCl3、Na2CO3中的一种或几种。为确定该固体粉末的成分,现取X进行如下实验:①X与足量稀硝酸反应,得到气体1和溶液2
②溶液2中滴加足量的氨水,得到有色沉淀3
下列说法正确的是( )
A、气体1可能为SO2和CO2的混合物 B、沉淀3可能为Fe(OH)3和Al(OH)3的混合物 C、固体粉末X中一定有FeCl3、Na2CO3 , 可能有KAlO2 D、往溶液2中加入Cu粉,若溶解,说明X中含有FeCl3固体粉末二、非选择题(本大题共4小题,共50分)
-
26.(1)、氨气分子构型 ;比较结合H*能力的相对强弱:H2ONH3(填“>”、“<”或“=”) ,用一个离子方程式说明H3O+和NH4+给出H+能力的相对强弱。(2)、某钾盐X(摩尔质量介于200g*mol-1~300g*mol-1之间) 具有强氧化性,由三种常见的元素组成,有如下转化关系:

请回答下列问题:
X中除钾元素外还含有元素、。(填元素名称)
(3)、请写出产生白色沉淀的离子反应方程式。(4)、X与水在一定条件下发生反应,生成两种物质,一种为酸式盐,另一种具有漂白性,请写出X与水反应的化学方程式:。27. 工业上大量排放的NOx、SO2、CO2都会污染环境,如何治理环境和利用资源是科学研究中的重要课题。(1)、利用活性炭的还原性可处理汽车尾气,发生如下反应:C(s)+2NO(g) N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度时间的变化如表所示:
时间/mim
浓度/(mol/L)
0
10
20
30
40
50
NO
2.0
1.16
0.40
0.40
0.60
0.60
N2
0
0.42
a
b
1.20
1.20
CO2
0
0.42
a
b
1.20
1.20
①0-20min内的平均反应速率v(CO2)=mol/(L·min)。
②30min时只改变某一条件,则可能的变化是(填字母编号)。
a.升高温度
b.降低温度
c.再通入一定量的NO
d.缩小容器的体积
e.加入合适的催化剂
f.增大容器体积
(2)、焦炭催化还原二氧化硫的化学方程式为2C(s) +2SO2(g) S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的反应速率与S2(g)的生成速率随温度变化的关系如图所示:A,B,C,D四点对应的状态中,达到平衡状态的有 (填字母)。 (3)、高温下碳可将难溶的重晶石转化为BaS:
(3)、高温下碳可将难溶的重晶石转化为BaS:反应1:BaSO4(s)+4C(s) 4CO(g)+BaS(s) △H=+571.2kJmol-1
反应2:BaSO4(s)+4C(g) 4CO2(g) +BaS(s) △H=-18.8kJmol-1
①保持温度不变,若t2时刻将容器体积减小为一半,t3时刻达到新的平衡,请在下图继续画出t2~t4区间c(CO)的变化曲线。

②科学家将大量排放的CO2作为新碳源的研究引起国际关注,以新型的二氧化钛为催化剂,可以将CO2和CH4直接转化成乙酸。催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
 28. Mg(ClO3)2·3H2O为强氧化性物质,在工农业上有重要用途,其制备原理为:MgCl2+2NaClO3+3H2O=Mg(ClO3 )2·3H2O+2NaCl。
28. Mg(ClO3)2·3H2O为强氧化性物质,在工农业上有重要用途,其制备原理为:MgCl2+2NaClO3+3H2O=Mg(ClO3 )2·3H2O+2NaCl。实验室制备Mg(ClO3)2·3H2O的过程如图1:

已知四种化合物的溶解度(S)与温度(T)的变化曲线关系如图2所示:
 (1)、抽滤装置中仪器A的名称是。图示装置不合理之处有。(2)、操作X是 。(3)、“溶解”时加水太多会明显降低Mg(ClO3)2·3H2O的产率且杂质增加,其原因是 。(4)、下列有关实验过程(如图3)与操作说法不正确的是 。A、为快速获得产品,冷却时可用冰水 B、洗涤时应用无水乙醇 C、抽滤Mg(ClO3)2·3H2O时,可用略小于漏斗内径又能盖住小孔的滤纸 D、抽滤时,当吸滤瓶中液面快到支管时,应拔掉橡皮管,将滤液从支管口倒出(5)、称取3.000g样品, 加水溶解并加过量的NaNO2溶液充分反应, 配制成250mL溶液,取25mL溶液加足量稀硝酸酸化并加入合适的指示剂,用0.1000mol·L-1的AgNO3标准溶液滴定至终点, 平均消耗标准液24.00mL。则样品中Mg(ClO3)2·3H2O的纯度是。
(1)、抽滤装置中仪器A的名称是。图示装置不合理之处有。(2)、操作X是 。(3)、“溶解”时加水太多会明显降低Mg(ClO3)2·3H2O的产率且杂质增加,其原因是 。(4)、下列有关实验过程(如图3)与操作说法不正确的是 。A、为快速获得产品,冷却时可用冰水 B、洗涤时应用无水乙醇 C、抽滤Mg(ClO3)2·3H2O时,可用略小于漏斗内径又能盖住小孔的滤纸 D、抽滤时,当吸滤瓶中液面快到支管时,应拔掉橡皮管,将滤液从支管口倒出(5)、称取3.000g样品, 加水溶解并加过量的NaNO2溶液充分反应, 配制成250mL溶液,取25mL溶液加足量稀硝酸酸化并加入合适的指示剂,用0.1000mol·L-1的AgNO3标准溶液滴定至终点, 平均消耗标准液24.00mL。则样品中Mg(ClO3)2·3H2O的纯度是。反应原理的离子方程式:ClO3-+Ag++3NO2-=AgCl↓+3NO3-
29. 有机物X是化工产品的重要中间体,现以甲苯及常见有机原料合成X的流程如下:
已知:2CH3CHO CH3CH=CHCHO
试回答下列问题:
(1)、有机物X中的官能团名称。(2)、下列有关有机物X的说法正确的是 。A、分子式是C9H10NO2 B、属于α-氨基酸 C、能发生取代反应和缩聚反应 D、能形成内盐(3)、写出X→Y的化学方程式。(4)、分子式为C7H7NO2且符合下列条件的芳香族同分异构体有多种,写出其中4种的结构简式。①能与NaOH反应
②-NH2直接与苯环连接
(5)、设计上述流程中 的合成路线(无机试剂及溶剂任选)。
的合成路线(无机试剂及溶剂任选)。