四川省广安市2020年中考化学试卷
试卷更新日期:2020-08-06 类型:中考真卷
一、单选题
-
1. 2020年世界环境日的主题是“关爱自然,刻不容缓”,下列做法不符合这一主题的是( )A、大量使用含磷洗涤剂 B、尽量少用一次性塑料和餐盒,减少白色污染 C、关爱与保护野生动植物 D、将垃圾分类投放,变废为宝2. 化肥对提高农作物的产量有重要作用,下列物质可用作氮肥的是( )A、CaSO4 B、K2SO4 C、NH4NO3 D、Ca3(PO4)23. 化学与生活密切相关,下列说法错误的是( )A、金刚石可用来裁玻璃,切割大理石,加工坚硬的金属 B、霉变的食物蒸煮后,可以继续食用 C、缺乏维生素C,会引起坏血病 D、甲醛对人体健康有严重危害4. 下列图示实验操作正确的是( )A、闻气体气味
 B、检查气密性
B、检查气密性 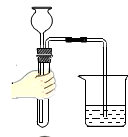 C、加热液体
C、加热液体 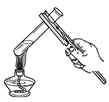 D、点燃酒精灯
D、点燃酒精灯 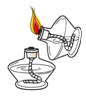 5. “新冠”重症患者需要使用呼吸机来为其提供氧气,下列关于氧气的描述错误的是( )A、在通常状况下,氧气是一种无色、无味的气体 B、氧气在低温、高压时能变为液体或固体 C、氧气极易溶于水 D、隔绝氧气能达到灭火的目的6. 下列物质的分类,正确的一组是( )
5. “新冠”重症患者需要使用呼吸机来为其提供氧气,下列关于氧气的描述错误的是( )A、在通常状况下,氧气是一种无色、无味的气体 B、氧气在低温、高压时能变为液体或固体 C、氧气极易溶于水 D、隔绝氧气能达到灭火的目的6. 下列物质的分类,正确的一组是( )选项物质
A
B
C
D
液氮
单质
单质
化合物
化合物
清洁的空气
纯净物
混合物
纯净物
混合物
干冰
氧化物
氧化物
酸
酸
NH4Cl
盐
盐
碱
碱
A、A B、B C、C D、D7. 形状记忆合金是具有形状记忆效应的合金,人造卫星和宇宙卫星上的天线是由钛镍形状记忆合金制造的。如图所示是钛元素在元素周期表中的信息。下列关于钛的说法错误的是( )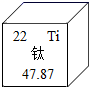 A、元素符号是Ti B、钛原子核外有22个电子 C、钛的核电荷数为22 D、钛的相对原子质量为47.87g8. 下列关于金属的说法正确的是( )A、铜质插头利用了铜的导电性 B、硬铝的硬度比铝小 C、在金属表面喷涂油漆是防止其锈蚀的唯一方法 D、Ag能将硝酸铜溶液中的铜置换出来9. 下列实验操作(方案)不能达到实验目的(结果)的是( )
A、元素符号是Ti B、钛原子核外有22个电子 C、钛的核电荷数为22 D、钛的相对原子质量为47.87g8. 下列关于金属的说法正确的是( )A、铜质插头利用了铜的导电性 B、硬铝的硬度比铝小 C、在金属表面喷涂油漆是防止其锈蚀的唯一方法 D、Ag能将硝酸铜溶液中的铜置换出来9. 下列实验操作(方案)不能达到实验目的(结果)的是( )选项
实验操作(方案)
实验目的(结果)
A
向试管中加入适量蒸馏水和2滴紫色石蕊溶液,通入CO2后振荡,再对试管加热
证明碳酸不稳定
B
向试管中加入2mL浓氨水,将蘸有酚酞溶液的棉花靠近试管的管口
证明分子在不停运动
C
将燃着的木条伸入集气瓶中
检验集气瓶中是否集满二氧化碳
D
将固体药品放在托盘天平的右盘称量
称量结果可能偏小
A、A B、B C、C D、D10. 2020年6月23日北京时间9点43分,四川西昌卫星发射中心将北斗三号最后一颗全球组网卫星发射成功。其火箭使用的一种燃料是偏二甲肼(C2H8N2),四氧化二氮(N2O4)为氧化剂,反应的化学方程式为 。下列说法错误的是( )A、C2H8N2由碳、氢、氮三种元素组成 B、X为一种有毒的物质 C、生成的N2的化学性质不活泼,可以在食品包装中充氮气以防腐 D、C2H8N2中碳的质量分数为40%11. 物质的类别和核心元素的化合价是研究物质性质的两个重要维度,如图所示,A~F是初中化学常见的六种不同类别的物质,且都含氧元素,各物质中均有某种组成元素的化合价与纵坐标的数值相对应。下列说法正确的是( )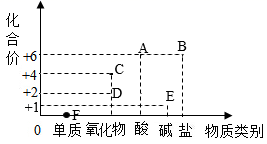 A、F可能为氮气 B、D可能为Fe2O3 C、B和E一定能发生化学反应 D、A和E的反应可能为12. 酸、碱、盐在生产生活中具有广泛的用途,某固体粉末可能含有CaCO3、Na2SO4、NaCl、BaCl2、CuSO4中的一种或几种。为确定其组成,进行如下实验:
A、F可能为氮气 B、D可能为Fe2O3 C、B和E一定能发生化学反应 D、A和E的反应可能为12. 酸、碱、盐在生产生活中具有广泛的用途,某固体粉末可能含有CaCO3、Na2SO4、NaCl、BaCl2、CuSO4中的一种或几种。为确定其组成,进行如下实验:步骤
实验操作
现象或结论
步骤1
取少量固体粉末加入足量的蒸馏水溶解并过滤
得到白色沉淀A和无色滤液B
步骤2
向A中加入足量的稀盐酸
沉淀全部溶解并有气体放出
步骤3
向B中加入足量的Ba(NO3)2溶液
产生白色沉淀C
下列说法错误的是( )
A、白色沉淀A为CaCO3 B、白色沉淀C为BaSO4 C、原固体粉末中肯定含有Na2SO4 D、原固体粉末中肯定不含NaCl二、填空题
-
13. 到2020年,元素周期表已经诞生151周年。从H、C、O、Na、Al、Cl元素中选择,用化学用语填空。(1)、由上述元素组成的氧化物(任写1种)。(2)、2个甲烷分子。(3)、由上述元素组成的酸(任写1种)。(4)、氯元素在反应中容易(填“得到”或“失去”)1个电子,形成的离子符号为。14. 端午节是我国的传统节日,有赛龙舟、吃粽子、喝雄黄酒的习俗。回答下列问题:(1)、包粽子用到的材料有箬竹叶、糯米、食盐、瘦肉等,其中富含蛋白质的是。(2)、泡制雄黄酒所用到的白酒中的乙醇(C2H5OH)属于物(填“无机”或“有机”)。(3)、《本草纲目》记载:“雄黄,乃治疮杀毒要药也,而入肝经气分,故肝风,肝气,惊痫,痰涎,头痛眩晕,暑疟泄痢,积聚诸病,用之有殊功;又能化血为水。而方士乃炼治服饵,神异其说,被其毒者多矣。”雄黄又名鸡冠石,主要成分为As4S4 , 在空气中加热到一定温度可以被氧化成剧毒成分三氧化二砷。反应方程式为: 。As2O3中As的化合价为 , 硫(俗称硫黄)在空气中燃烧的现象为。15. 下表是KNO3、NaCl在不同温度下的溶解度:
温度/℃
10
20
30
40
50
60
70
80
90
溶解度/g
KNO3
20.9
32
45.8
64
85.5
110
138
169
202
NaCl
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
根据上表信息,完成下列各题
(1)、60℃时,KNO3的溶解度为。(2)、溶解度受温度的影响较大的物质是。(3)、10℃时,将KNO3和NaCl的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者后者(填“大于”“小于”或“等于”)。(4)、20℃时,15gNaCl加入到40g水中充分溶解所得溶液的质量为。三、流程题
-
16. 无水氯化钙(CaCl2)是重要的干燥剂,CaCl2·6H2O与冰的混合物是实验室常用的制冷剂,将CaCl2·6H2O加热可得CaCl2。某工厂以石灰石为原料生产无水氯化钙的流程如图所示,原料石灰石中含有的杂质主要是MgCO3、MgSO4。
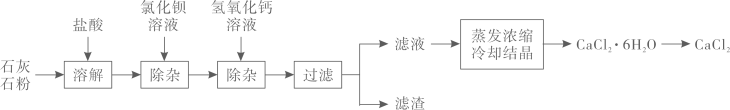 (1)、过滤和蒸发均用到的玻璃仪器是。(2)、石灰石溶解时,杂质MgCO3发生反应的化学方程式为 , 该反应是(填基本反应类型)(3)、加入BaCl2溶液除去的杂质离子是 , 加入氢氧化钙溶液除杂的化学方程式为。(4)、由CaCl2·6H2O得到CaCl2是变化(填“物理”或“化学”)。
(1)、过滤和蒸发均用到的玻璃仪器是。(2)、石灰石溶解时,杂质MgCO3发生反应的化学方程式为 , 该反应是(填基本反应类型)(3)、加入BaCl2溶液除去的杂质离子是 , 加入氢氧化钙溶液除杂的化学方程式为。(4)、由CaCl2·6H2O得到CaCl2是变化(填“物理”或“化学”)。四、计算题
-
17. 73g盐酸与足量锌粒反应,生成的气体在标准状况下的体积为4.48L。(在标准状况下,氢气的密度为0.0899g/L)(1)、生成的气体的质量为(结果保留1位小数)(2)、计算盐酸中溶质的质量分数(写出计算过程)
五、实验题
-
18. 下图是实验室制取气体的几种发生装置和收集装置。回答下列问题:
 (1)、仪器名称①。(2)、实验室既可用于制取氧气又可用于制取二氧化碳的发生和收集装置的组合为(填字母),用该发生装置制取氧气的化学方程式为。(3)、已知NO难溶于水,常温下很容易与空气中的O2反应生成NO2。实验室制取NO,应选用的收集装置为(填字母)。气体应从端(填“f”“j”“h”或“i”)通入。(4)、实验室常用氯化铵和氢氧化钙两种固体混合物在加热条件下制取NH3 , 可选用的发生装置为(填字母)。
(1)、仪器名称①。(2)、实验室既可用于制取氧气又可用于制取二氧化碳的发生和收集装置的组合为(填字母),用该发生装置制取氧气的化学方程式为。(3)、已知NO难溶于水,常温下很容易与空气中的O2反应生成NO2。实验室制取NO,应选用的收集装置为(填字母)。气体应从端(填“f”“j”“h”或“i”)通入。(4)、实验室常用氯化铵和氢氧化钙两种固体混合物在加热条件下制取NH3 , 可选用的发生装置为(填字母)。六、科学探究题
-
19. 亚硝酸钠是一种工业用盐,外形与食盐相似,有咸味,有毒。人若误食会引起中毒,甚至致人死亡。已知亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。(1)、鉴别亚硝酸钠和氯化钠,你会选用什么试剂?如何操作?。(2)、某实验小组成员李雷从人教版普通高中教科书《化学1》中得知碳酸钠的水溶液也呈碱性。该组成员就碳酸钠溶液呈碱性的原因进行了如下初探:
(查阅资料)
Ⅰ.大多数可溶性的盐溶解在水中会完全解离,产生自由移动的阴阳离子。如Na2CO3、KCl等。
Ⅱ.难溶性物质在水中解离出的阴阳离子极少,忽略不计。如CaCO3、BaCO3等。
Ⅲ.CaCl2的水溶液呈中性。
(猜想与假设)猜想Ⅰ:碱性是由溶液中解离出的Na+引起的;
猜想Ⅱ:碱性是由溶液中解离出的CO32-引起的;
……………….
(实验设计)
实验步骤
实验现象
向1支洁净的小试管中加入3mL饱和碳酸钠溶液,滴入3滴酚酞溶液,振荡,再逐滴滴入氯化钙溶液至过量
试管中溶液颜色先由无色变为红色,然后逐渐变浅至消失
写出上述实验步骤中滴入CaCl2溶液后红色变浅至消失的原因(用化学方程式解释)
(实验结论)
(实验拓展)据此判断下列物质的水溶液可能使酚酞溶液变红的是(填字母)
A、CaCl2
B、CaCO3
C、H2SO4
D、K2CO3
(总结反思)该组同学善于发现问题,并设计实验探究问题。通过本次探究,他们认识到,并不是碱溶液才显碱性,盐溶液也可能呈碱性。他们还会进一步查阅资料探寻碳酸钠溶液呈碱性的本质原因和基本规律。
-
-
-