广东省2020年中考化学试卷
试卷更新日期:2020-08-06 类型:中考真卷
一、单选题
-
1. 下列过程发生了化学变化的是( )A、冰雪融化 B、汽油挥发 C、大米酿酒 D、玻璃破碎2. 下列广东美食中富含淀粉的是( )A、客家豆腐 B、广式腊肠 C、深井烧鹅 D、陈村米粉3. 酒精运输车合适位置应张贴的标志是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列物质属于空气污染物的是( )A、氧气 B、氮气 C、水蒸气 D、二氧化硫5. Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于( )A、氧化物 B、盐 C、有机物 D、混合物6. 公园里能闻到花香,合理的解释是( )A、分子体积变大 B、分子在不断运动 C、分子数目变多 D、分子发生了分解7. 合成材料的应用与发展,大大方便了人类的生活。下列物品是用有机合成材料制作的是( )A、塑料桶 B、纯羊毛衫 C、铅笔芯 D、青铜铸像8. 稀土有“工业的维生素”的美誉。钇是一种重要的稀土元素,下列说法中错误的是( )
4. 下列物质属于空气污染物的是( )A、氧气 B、氮气 C、水蒸气 D、二氧化硫5. Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于( )A、氧化物 B、盐 C、有机物 D、混合物6. 公园里能闻到花香,合理的解释是( )A、分子体积变大 B、分子在不断运动 C、分子数目变多 D、分子发生了分解7. 合成材料的应用与发展,大大方便了人类的生活。下列物品是用有机合成材料制作的是( )A、塑料桶 B、纯羊毛衫 C、铅笔芯 D、青铜铸像8. 稀土有“工业的维生素”的美誉。钇是一种重要的稀土元素,下列说法中错误的是( ) A、钇属于金属元素 B、钇的原子序数是39 C、钇的相对原质量是88.91克 D、钇原子的核外电子数为399. 下列除杂方法正确的是( )
A、钇属于金属元素 B、钇的原子序数是39 C、钇的相对原质量是88.91克 D、钇原子的核外电子数为399. 下列除杂方法正确的是( )选项
物质(括号内为杂质)
方法
A
K2CO3溶液(K2SO4)
加BaCl2溶液,过滤
B
N2(O2)
将气体通过灼热的铜网
C
NaOH溶液(Na2CO3)
加入稀硫酸
D
ZnSO4溶液(CuSO4)
加入过量的铁粉,过滤
A、A B、B C、C D、D10. 化学与生产、生活密切相关,下列说法错误的是( )A、人体缺碘会引起贫血 B、碳酸氢铵(NH4HCO3)是一种氮肥 C、炒菜时油锅着火,用锅盖盖灭 D、铁制品表面刷漆可防止生锈11. 20gKOH加入100g水中,配制成溶液。下列说法错误的是( )A、KOH在水中解离出K+和OH- B、一个K+带一个单位正电荷 C、该溶液的溶质质量分数为20% D、向该溶液中滴入酚酞指示剂,溶液变红12. 如图是KNO3的溶解度曲线,下列说法正确的是( ) A、溶液从b点降温到a点,有晶体析出 B、60℃时,b、c点对应的都是饱和溶液 C、将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液 D、60℃时,向50g水中加入60gKNO3 , 形成不饱和溶液13. 实验室用氯酸钾固体(二氧化锰作催化剂)制取氧气,下列装置组合正确的是( )
A、溶液从b点降温到a点,有晶体析出 B、60℃时,b、c点对应的都是饱和溶液 C、将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液 D、60℃时,向50g水中加入60gKNO3 , 形成不饱和溶液13. 实验室用氯酸钾固体(二氧化锰作催化剂)制取氧气,下列装置组合正确的是( ) A、①③ B、①⑤ C、②③ D、②④14. 2020年我国在抗击新冠肺炎战役中取得了阶段性重大成果。为防控疫情,通常在公共场所使用84消毒液(主要成分是NaClO)进行消毒。NaClO中氯元素的化合价是( )A、-1 B、0 C、+1 D、+515. 下列各组物质不能实现如图所示的转化关系的是( )
A、①③ B、①⑤ C、②③ D、②④14. 2020年我国在抗击新冠肺炎战役中取得了阶段性重大成果。为防控疫情,通常在公共场所使用84消毒液(主要成分是NaClO)进行消毒。NaClO中氯元素的化合价是( )A、-1 B、0 C、+1 D、+515. 下列各组物质不能实现如图所示的转化关系的是( )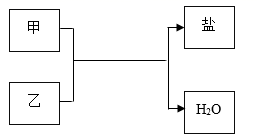
选项
甲
乙
A
Fe2O3
稀硫酸
B
SO3
NaOH溶液
C
稀盐酸
Ca(OH)2溶液
D
稀盐酸
AgNO3溶液
A、A B、B C、C D、D二、填空题
-
16. 2020年6月23日,我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用。(1)、铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝的(填“高”或“低”)。(2)、写出铝与稀盐酸反应的化学方程式 , 其反应类型是。(3)、室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的(填“强”或“弱”)。(4)、卫星发射过程中使用偏二甲肼(C2H8N2)和四氧化二氮作为推进剂。在C2H8N2中,碳、氢元素的质量比为。17. H2被视为未来理想的清洁能源,科学家对氢的研究从未停歇。
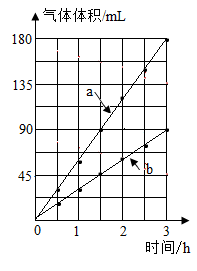 (1)、H2是清洁能源的原因是。(2)、2020年5月,Nature期刊报道了一种新型催化剂用于光催化分解水,结果表明,水分解生成的两种气体的体积与时间的关系如图所示,其中表示氢气的是(填“a”或“b”)。(3)、2020年5月,科学家在Science期刊上首次报道了原子与分子的“最简单”反应存在两种路径,并用先进技术手段拍下了该反应的影像资料,其中一种路径的简化示意图如图所示。
(1)、H2是清洁能源的原因是。(2)、2020年5月,Nature期刊报道了一种新型催化剂用于光催化分解水,结果表明,水分解生成的两种气体的体积与时间的关系如图所示,其中表示氢气的是(填“a”或“b”)。(3)、2020年5月,科学家在Science期刊上首次报道了原子与分子的“最简单”反应存在两种路径,并用先进技术手段拍下了该反应的影像资料,其中一种路径的简化示意图如图所示。
此“最简单”反应中,
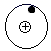 表示H原子,
表示H原子,  表示D原子。
表示D原子。
D原子核中有个质子,此反应中涉及的元素种类有种。该反应可表示为H+→H2+三、实验题
-
18. 实验室对含有MgCl2的粗盐进行提纯,步骤如图”:
 (1)、步骤①中,称量50g粗盐需补充的主要仪器是。(2)、步骤②中,玻璃棒的作用是。(3)、步骤③中,滴加过量NaOH溶液除去MgCl2 , 反应的化学方程式是。(4)、步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是______(填字母)。A、稀盐酸 B、稀硫酸 C、稀硝酸(5)、步骤⑥的操作名称是 , 当时,停止加热。
(1)、步骤①中,称量50g粗盐需补充的主要仪器是。(2)、步骤②中,玻璃棒的作用是。(3)、步骤③中,滴加过量NaOH溶液除去MgCl2 , 反应的化学方程式是。(4)、步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是______(填字母)。A、稀盐酸 B、稀硫酸 C、稀硝酸(5)、步骤⑥的操作名称是 , 当时,停止加热。四、科学探究题
-
19. 某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2 , C还能使CO2转变成CO。于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。(1)、(猜想与假设)C还原CuO时产生的CO2与C进步反应生成CO,化学方程式是。(2)、(查阅资料)CO不与NaOH、Ca(OH)2及H2SO4反应。
(实验方案)取研细和干燥后的木炭(0.3g)和CuO(2.0g),混合均匀并装入试管,连接装置,高温反应,检验气体。
(实验过程)
由如图装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为________→尾气处理(填字母)。
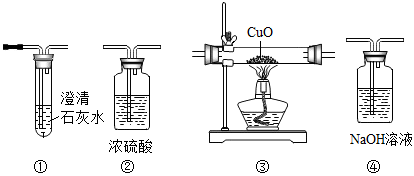 A、①→②→③→④ B、④→①→②→③→① C、①→④→①→③→② D、③→④→①→②(3)、上述进一步确定CO存在的现象是(装置③中粉末的颜色变化除外)。(4)、装置③中发生反应的化学方程式是。(5)、写出CO尾气处理的方法:(一种即可)。
A、①→②→③→④ B、④→①→②→③→① C、①→④→①→③→② D、③→④→①→②(3)、上述进一步确定CO存在的现象是(装置③中粉末的颜色变化除外)。(4)、装置③中发生反应的化学方程式是。(5)、写出CO尾气处理的方法:(一种即可)。(实验结论)高温下,过量木炭还原CuO的气体产物中有CO。
(延伸应用)冬天,室内用炭火取暖时,应注意。
五、流程题
-
20. 某废酸液主要含H2SO4和FeSO4 , 研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下:
 (1)、该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。(4)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。(5)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。
(1)、该废酸液的pH7(填“<”或“>”)。操作Ⅰ的名称为。(2)、电石渣转化为石灰乳的过程会(填“吸收”或“放出”)热量。(3)、“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是和(填化学式)。(4)、磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为。(5)、研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为。pH较低时产率较低的主要原因是。溶液的pH
6.0
6.5
7.0
7.5
8.0
9.0
产物颜色
黄褐色
黄褐色
较黑
很黑
很黑
灰黑色
产率(%)
43.9
50.6
86.2
93.0
92.3
91.6
六、计算题
-
21. 某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图所示。

试验编号
H2O2的质量分数(%)
H2O2溶液的体积(mL)
对应曲线
Ⅰ
3.4
10.0
a
Ⅱ
2.4
10.0
b
Ⅲ
1.7
10.0
c(待绘制)
(1)、实验前需准备不同浓度的H2O2溶液,若要配制100g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液g。(2)、根据实验探究目的,从曲线a、b中,可得出的结论是。(3)、计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5-5.0%H2O2溶液的密度取值1.0g/mL)。(4)、在图中画出曲线c的大致位置及趋势。
-
-
-