高中化学人教版(2019)必修第一册 第二章测试卷
试卷更新日期:2020-07-31 类型:单元试卷
一、单选题
-
1. 如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是( )
 A、甲、乙、丙都属于氧化还原反应 B、甲反应的离子方程式为Na+2H2O=Na++2OH-+H2↑ C、丙充分反应,能产生0.05 mol O2 , 转移电子0.1 mol D、甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3 , 则2w1=w2=w32. 钠加热后能在空气中着火燃烧的现象是( )A、黄色火焰,生成白色固体Na2O B、黄色火焰,生成淡黄色固体Na2O2 C、紫色火焰,生成淡黄色固体Na2O2 D、红色火焰,生成黄色固体Na2O3. 下列对进行焰色反应实验操作注意事项的说明,正确的是( )
A、甲、乙、丙都属于氧化还原反应 B、甲反应的离子方程式为Na+2H2O=Na++2OH-+H2↑ C、丙充分反应,能产生0.05 mol O2 , 转移电子0.1 mol D、甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3 , 则2w1=w2=w32. 钠加热后能在空气中着火燃烧的现象是( )A、黄色火焰,生成白色固体Na2O B、黄色火焰,生成淡黄色固体Na2O2 C、紫色火焰,生成淡黄色固体Na2O2 D、红色火焰,生成黄色固体Na2O3. 下列对进行焰色反应实验操作注意事项的说明,正确的是( )①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸被检物质
③每次实验后,要用硫酸把铂丝洗净
④没有铂丝,也可用光洁无锈的铁丝代替
A、仅有③不正确 B、仅有④不正确 C、仅有②不正确 D、全对4. 下列关于氯水的说法正确的是( )A、新制氯水含有 Cl2、HCl、HClO、H2O 分子 B、紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色 C、氯水和液氯都能使干燥的有色布条褪色 D、新制氯水的 pH 值要比久置氯水的 pH 值小5. 下列说法不正确的是( )A、Na2O2可以作为呼吸面具或潜水艇里的氧气来源 B、将Na2O加到酚酞溶液中,溶液先变红色后褪色 C、可用水来检验某Na2O样品中是否含有Na2O2 D、过氧化钠为淡黄色固体粉末6. 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3 , A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )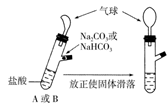 A、B装置的气球膨胀的体积大 B、最终两试管中NaCl的物质的量一定相同 C、若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L D、若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L7. 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确的是( )
A、B装置的气球膨胀的体积大 B、最终两试管中NaCl的物质的量一定相同 C、若最终两气球体积不同,则盐酸的浓度一定小于或等于1mol/L D、若最终两气球体积相同,则盐酸的浓度一定大于或等于2mol/L7. 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确的是( ) A、oa段反应的离子方程式为:H++OH-=H2O B、O点溶液中所含溶质的化学式为NaHCO3、Na2CO3 C、标准状况下,通入CO2的体积为4.48L D、原NaOH溶液的物质的量浓度为2.5mol•L﹣18. 某溶液中含有 HCO3-、SO32-、CO32-、CH3COO-等 4 种阴离子。若向其中加入足量的Na2O2 后,溶液中离子浓度变化最小的是( )A、CO32- B、SO32- C、CH3COO- D、HCO3-9. 已知还原性由强到弱的顺序为SO32-> I->Br- , 向NaBr、NaI、Na2SO3的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是( )A、NaCl B、NaCl、Na2SO4、NaI C、NaCl、Na2SO4、I2 D、NaCl、NaBr、Na2SO410. 实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量( )A、①比②多 B、②比①多 C、一样多 D、无法比较11. 如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
A、oa段反应的离子方程式为:H++OH-=H2O B、O点溶液中所含溶质的化学式为NaHCO3、Na2CO3 C、标准状况下,通入CO2的体积为4.48L D、原NaOH溶液的物质的量浓度为2.5mol•L﹣18. 某溶液中含有 HCO3-、SO32-、CO32-、CH3COO-等 4 种阴离子。若向其中加入足量的Na2O2 后,溶液中离子浓度变化最小的是( )A、CO32- B、SO32- C、CH3COO- D、HCO3-9. 已知还原性由强到弱的顺序为SO32-> I->Br- , 向NaBr、NaI、Na2SO3的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是( )A、NaCl B、NaCl、Na2SO4、NaI C、NaCl、Na2SO4、I2 D、NaCl、NaBr、Na2SO410. 实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量( )A、①比②多 B、②比①多 C、一样多 D、无法比较11. 如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项
实验现象
解释
A
干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝
NH3是一种可溶性碱
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是MgCl2溶液
D
浓盐酸附近产生白烟
NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体
A、A B、B C、C D、D12. Cl2与NaOH溶液反应,当反应温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法错误的是( )A、若产物为NaClO、NaCl,则反应后的溶液中n(ClO-) = n(Cl-) B、若产物为NaClO、NaClO3、NaCl,则参加反应NaOH与Cl2物质的量之比一定为2∶1 C、若产物为NaClO、NaClO3、NaCl,则由反应后溶液中n(Cl-)和n(ClO3-)可计算反应的n(Cl2) D、若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶513. 用NA表示阿伏加德罗常数,下列叙述正确的是( )A、标准状况下,22.4L H2O含有的分子数为1NA B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA C、通常状况下,1NA个CO2分子占有的体积为22.4L D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA14. 配制一定物质的量浓度的溶液,如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度与所要求的相比( )A、偏大 B、偏小 C、不变 D、无法确定15. 用 浓硫酸配制 的稀硫酸,用量筒量取浓硫酸时仰视刻度,则所配制溶液的浓度A、等于 B、大于 C、小于 D、无法确定16. 同温同压下,决定气体体积大小的因素是( )A、气体分子间的平均距离 B、气体分子的自身大小 C、气体分子的数目 D、气体分子的数目和气体分子的自身大小17. 完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl- , 消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为( )A、1:3:3 B、3:2:1 C、6:3:2 D、9:3:118. 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol•L﹣1 , c(K+)=0.6 mol•L﹣1 , c(SO42﹣)=0.8 mol•L﹣1 , 则c(Al3+)为( )A、0.1 mol•L﹣1 B、0.3 mol•L﹣1 C、0.6 mol•L﹣1 D、0.9 mol•L﹣1二、填空题
-
19. 下面是钠和氯气反应的实验设计:
实验步骤:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方,观察现象.
记录实验现象
现象
化学方程式
20. 将6.5 g锌放入足量的稀硫酸中充分反应,得到80 mL密度为1.25 g/mL的溶液。试计算回答:①所得溶液中硫酸锌的物质的量浓度为 , 质量分数为。
②生成的气体在标准状况下的体积为。
21. 在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。①此混合物中CO和CO2的物质的量比是 , ②CO的体积分数是 , ③CO的质量分数是 , ④C和O的原子个数比是 , ⑤混合气体的平均摩尔质量是。22. 现有1L的 Al2(SO4)3溶液,含Al3+216g,取250mL溶液稀释到4L,则稀释后溶液中SO42﹣的物质的量浓度是 .三、综合题
-
23. 有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W X + H2O + CO2↑
②Z +CO2 → X + O2
③Z+H2O → Y + O2↑
④X + Ca(OH)2 → Y + CaCO3↓
试回答下列问题:
(1)、W、X、Y、Z的化学式分别是:W , X , Y , Z。(2)、以上4个化学反应,属于氧化还原反应的是(填反应序号)。(3)、若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:①离子方程式:。
②化学方程式:。
24. 过氧化钠能与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,该反应也可用于实验室制取氧气。某同学用该反应制取标准状况下1.12L氧气。(1)、计算至少需要称取过氧化钠的质量。(2)、若反应所得氢氧化钠溶液的体积是200mL,计算该溶液中溶质的物质的浓度。25. 按要求填空:(1)、写出新制氯水中含量最多的微粒的化学式(水分子除外)(2)、写出漂白粉中有效成分的名称(3)、描述检验溶液中K+离子的实验操作过程(4)、配平下列化学方程式()Cu+()HNO3(稀)=()Cu(NO3)2+()NO↑+()H2O
(5)、按照物质的分类,次磷酸(H3PO2)属于二元酸,其与足量的NaOH溶液反应的化学方程式为26. 2004年4月15日,重庆某化工厂氯气泄露并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:(1)、爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为;形成烟的成分包含Cl2与Fe反应的产物 , Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式。(2)、Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:。(3)、用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该反应中氧化剂是 , 还原剂是 , 氧化剂与还原剂的物质的量之比为;若生成1mol ClO2则转移电子数为(NA表示阿伏加德罗常数)。27. 某学习小组探究潮湿的Cl2与Na2CO3反应的产物,进行如下实验根据设计要求回答: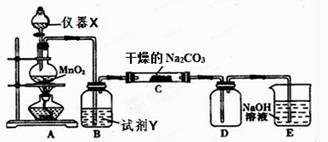 (1)、X仪器名称是 , 写出烧瓶中反应的离子方程式。(2)、试剂Y是 , E装置中反应的离子方程式。(3)、装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,固体产物两种,其中之一NaHCO3 , 写出反应的化学方程式。(4)、设计实验方案验证C中生成的固体中存在HCO3ˉ。28. 某课题研究小组的同学探究钠与水反应之后,又研究了与溶液反应和NaCl溶液的配制。(1)、Ⅰ.将金属钠放入盛有下列溶液的小烧杯中:①Fe2(SO4)3溶液 ②NaCl溶液 ③Na2SO4溶液 ④饱和澄清石灰水 ⑤Ca(HCO3)2溶液。回答下列问题:
(1)、X仪器名称是 , 写出烧瓶中反应的离子方程式。(2)、试剂Y是 , E装置中反应的离子方程式。(3)、装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,固体产物两种,其中之一NaHCO3 , 写出反应的化学方程式。(4)、设计实验方案验证C中生成的固体中存在HCO3ˉ。28. 某课题研究小组的同学探究钠与水反应之后,又研究了与溶液反应和NaCl溶液的配制。(1)、Ⅰ.将金属钠放入盛有下列溶液的小烧杯中:①Fe2(SO4)3溶液 ②NaCl溶液 ③Na2SO4溶液 ④饱和澄清石灰水 ⑤Ca(HCO3)2溶液。回答下列问题:既有气体,又有白色沉淀产生的是;
(2)、写出金属钠与①反应的离子方程式;(3)、若剩余的金属钠露置在空气中最终会变成。(4)、Ⅱ.配制480mL 0.2 mol·L-1 NaCl溶液。计算后,需称出NaCl质量为g。
(5)、在配制过程中,下列操作对所配溶液浓度的影响是(填偏高、偏低或无影响)①配制前,容量瓶内有水
②溶液未冷却便定容
③定容时仰视刻度线