高中化学人教版(2019)必修第一册 第二章第三节 物质的量
试卷更新日期:2020-07-31 类型:同步测试
一、单选题
-
1. NA是阿伏加德罗常数的值。下列说法正确的是( )A、22.4 L(标准状况)氮气中含有7NA个中子 B、1 mol重水比1 mol水多NA个质子 C、12 g石墨烯和12 g金刚石均含有NA个碳原子 D、1 L 1 mol·L−1 NaCl溶液含有28NA个电子2. 配制500mL 0.100mol·L-1”的NaCl溶液,部分实验操作示意图如下:
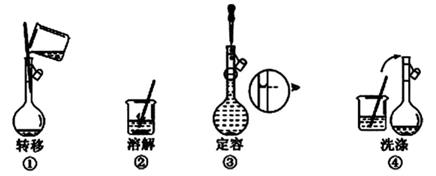
下列说法正确的是( )
A、实验中需用到的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等 B、上述实验操作步骤的正确顺序为①②④③ C、容量瓶需用自来水、蒸馏水洗涤,干燥后才可用 D、定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低3. 下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A、100mL 0.5 mol/L MgCl2溶液 B、200mL 0.25 mol/L HCl溶液 C、50mL 1mol/L NaCl溶液 D、200mL 0.25 mol/L CaCl2溶液4. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA B、标准状况下,22.4LH2O中含有的分子数为NA C、常温常压下,4g氦气中含氦原子数为NA D、过氧化钠与水反应时,生成1mol氧气转移的电子数为4NA5. 2V L Fe2(SO4)3溶液中含有a g SO42- , 取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( )
A、 mol·L-1 B、 mol·L-1 C、 mol·L-1 D、 mol·L-16. 用4mol/L的硫酸溶液配制450mL0.2mol/L的硫酸溶液,用不到的仪器是( )A、托盘天平 B、胶头滴管 C、烧杯 D、500mL容量瓶7. 某同学配制一定浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )A、所用NaOH已潮解 B、向容量瓶中加水未至刻度线 C、有少量NaOH溶液残留在烧杯里 D、移液前容量瓶中有少量蒸馏水8. 在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为A、0.10mol/L B、0.15mol/L C、0.20mol/L D、0.30mol/L9. 向25mL 2mol·L-1稀硫酸中加入25mL 1mol·L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(设稀溶液相混后总体积为原分体积之和)( )A、2mol·L-1 B、1mol·L-1 C、0.5mol·L-1 D、0.25mol·L-110. 某气体在标准状况下的密度为1.25 g / L,该气体的相对分子质量为( )A、44 B、28 C、32 D、1611. 某一Na2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为( )A、0.1mol/L B、0.15 mol/L C、0.2 mol/L D、0.25 mol/L12. 下列有关气体摩尔体积的描述正确的是( )A、通常状况下,气体摩尔体积约为22.4L B、标准状况下,气体摩尔体积约为22.4L C、相同物质的量的气体,摩尔体积相同 D、同温同压的气体,摩尔体积相同13. 常温常压下,用等质量的He、CH4、O2、SO2分别吹出四个气球,其中气体为He的是( )A、 B、
B、 C、
C、 D、
D、 14. VL Fe2(SO4)3溶液中含有a g Fe3+ , 取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中SO42-的物质的量的浓度为( )A、 B、 C、 D、15. 固体A在一定温度下分解生成气体B、C和D:2A(s)=B(g)+2C(g)+3D(g)。若测得生成气体的质量是相同体积的H2的15倍,则A的摩尔质量是( )
14. VL Fe2(SO4)3溶液中含有a g Fe3+ , 取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中SO42-的物质的量的浓度为( )A、 B、 C、 D、15. 固体A在一定温度下分解生成气体B、C和D:2A(s)=B(g)+2C(g)+3D(g)。若测得生成气体的质量是相同体积的H2的15倍,则A的摩尔质量是( )
A、30g/mol B、60g/mol C、90g/mol D、120g/mol16. 现有Ag某结晶水合物(R·xH2O)受热后失去全部结晶水,质量变为ag,则R相对原子质量是( )A、 B、 C、 D、二、填空题
-
17. 请将下表填写完整:
物质
物质的量
质量
分子或离子数目
SO2
2 mol
SO42-
6.02×1023
18. 常温下,欲配制密度为1.1g•cm﹣3、浓度为6mol•L﹣1的稀盐酸,在体积为100mL、密度为1.19g•cm﹣3、浓度为12mol•L﹣1的浓盐酸中需加蒸馏水 .19.(1)、6.02×1023个NH3 分子的质量为g,标准状况下的体积为L,与gCH4中含有的氢原子数相等。(2)、将标准状况下2.24LHCl气体溶于水,得到100mL溶液,则:该溶液的浓度为。取出20mL该溶液,所取出该溶液中溶质的质量是g。三、解答题
-
20. 在标准状况下,将1g氦气,11g二氧化碳和4g氧气混合,求该混合气体的体积。21. 实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配置240mL 0.1mol/L的盐酸.浓盐酸的物质量浓度为多少?配置稀盐酸应取用的浓盐酸的体积为多少?
四、综合题
-
22. 请根据物质的量的相关公式,完成下列问题。(注意书写单位)(1)、3.01×1023个NH3分子的物质的量。
(2)、0.5molH2SO4含有的氧原子的物质的量。
(3)、2.3gNO2的物质的量。
(4)、标况下,33.6LN2的物质的量。(5)、0.5mol /LK2SO4溶液中,c(K+)=。
23. 某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液500mL。实验室提供以下仪器:①100mL烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)。请回答下列问题:(1)、计算结果:需要称取NaOH固体g;(2)、配制时,必须使用的仪器有(填代号),还缺少的仪器是、。(填仪器名称)(3)、配制时,其正确的操作顺序是(字母表示,每个操作只用一次);
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)、实验两次用到玻璃棒,其作用分别是:先用于、后用于;(5)、若出现如下情况,其中将引起所配溶液浓度偏高的是;(填下列编号)①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④ 加蒸馏水时不慎超过刻度线
(6)、若实验过程中出现(5)中④这种情况你将如何处理?。24.(1)、绿色植物是空气天然的“净化器”,在家里科学选种一些绿色植物,可以达到净化空气、吸收有害物质的作用。科学研究发现,1公顷柳杉每月可以吸收160 kg SO2 , 则1公顷柳杉每月吸收的SO2的物质的量为。(2)、铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成不同型号的铅笔芯。如果某铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1 mg。那么一个铅笔字含有的碳原子数约为。(3)、吸食“摇头丸”会严重破坏人体的中枢神经,“摇头丸”的化学式为C9H13N,请计算:①“摇头丸”的摩尔质量为;
②某毒枭被查获带有270 g“摇头丸”,该毒枭所带的“摇头丸”的物质的量为。
(4)、将14.3 g Na2CO3·10H2O固体溶于水配成250 mL溶液,则所得溶液物质的量浓度是。