高中化学人教版(2019)必修第一册 第二章第二节 氯及其化合物
试卷更新日期:2020-07-31 类型:同步测试
一、单选题
-
1. 自来水可用氯气进行消毒,如在实验室用自来水配制下列物质的溶液,不会产生明显的药品变质问题的是( )A、AgNO3 B、NaOH C、Na2CO3 D、FeCl32. 下列关于氯水的叙述中正确的是( )A、新制氯水中只含有Cl2和H2O两种分子 B、新制氯水可以使蓝色石蕊试纸先变红后褪色 C、氯气、液氯和氯水是同一种物质 D、氯水放置数天后pH变大3. 氯气是一种很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 D、通常状况下,干燥的氯气能和Fe反应4. 实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。下列说法中错误的是( )
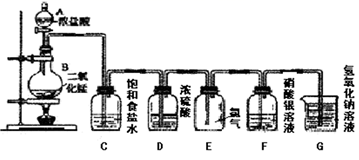 A、装置C的作用是除去氯气中的杂质HCl B、装置F中的现象为有白色沉淀产生 C、实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯 D、该实验中体现了浓盐酸的还原性和酸性5. 用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是( )A、漂白粉与氧气反应了 B、有色布条与氧气反应了 C、漂白粉跟空气中的 CO2反应生成了较多量的 HClO D、漂白粉溶液蒸发掉部分水,其浓度增大6. 下列说法错误的是( )
A、装置C的作用是除去氯气中的杂质HCl B、装置F中的现象为有白色沉淀产生 C、实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯 D、该实验中体现了浓盐酸的还原性和酸性5. 用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是( )A、漂白粉与氧气反应了 B、有色布条与氧气反应了 C、漂白粉跟空气中的 CO2反应生成了较多量的 HClO D、漂白粉溶液蒸发掉部分水,其浓度增大6. 下列说法错误的是( )①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A、① B、①和② C、①和④ D、①②③④7. 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是( )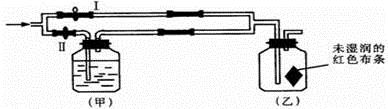 A、浓H2SO4 B、NaOH溶液 C、NaCl溶液 D、Ca(OH)2溶液8. 列关于氯气的实验装置能达到实验目的的是( )
A、浓H2SO4 B、NaOH溶液 C、NaCl溶液 D、Ca(OH)2溶液8. 列关于氯气的实验装置能达到实验目的的是( )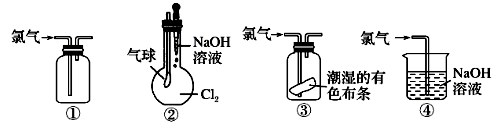
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A、①② B、①③ C、②③ D、①④9. 将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( )A、2/3 B、1/2 C、1/3 D、1/410. 下列说法中,错误的是:( )①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A、① B、①② C、①③④ D、①②③④11. 已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在 KClO3 晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )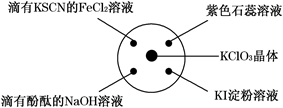
选项
实验现象
结论
A
滴有 KSCN 的 FeCl2 溶液变红色
Cl2 具有还原性
B
滴有酚酞的 NaOH 溶液褪色
Cl2 具有酸性
C
淀粉 KI 溶液中变蓝色
Cl2 具有氧化性
D
石蕊溶液先变为红色后褪色
Cl2 具有漂白性
A、A B、B C、C D、D12. 向下列物质的水溶液中加入AgNO3 , 有白色沉淀产生的是( )A、CH3Cl B、NaCl C、KClO3 D、CCl413. 下列说法正确的是( )A、Cl-和Cl2都有毒 B、将AgNO3溶液滴入甲溶液中,若出现白色沉淀,则说明甲溶液中含有Cl- C、将NaCl溶液滴入AgNO3溶液中或将Cl2通入AgNO3溶液中均会出现白色沉淀 D、含Cl-的溶液和氯水一样均呈黄绿色二、实验探究题
-
14. 氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:
 (1)、能证明氯水具有漂白性的是(填“a”“b”“c”“d”或“e”)。(2)、反应c过程中的现象是 , 反应e的化学方程式为 , 反应b的化学方程式为。(3)、久置的氯水最终会变成 , 用化学反应方程式表示为。(4)、实验室保存氯水的方法是。15. 某课外小组在实验室用二氧化锰和浓盐酸共热制备氯气,并进行氯气性质的研究。(1)、该小组同学欲用下图所示仪器及试剂制备并收集纯净、干燥的氯气。
(1)、能证明氯水具有漂白性的是(填“a”“b”“c”“d”或“e”)。(2)、反应c过程中的现象是 , 反应e的化学方程式为 , 反应b的化学方程式为。(3)、久置的氯水最终会变成 , 用化学反应方程式表示为。(4)、实验室保存氯水的方法是。15. 某课外小组在实验室用二氧化锰和浓盐酸共热制备氯气,并进行氯气性质的研究。(1)、该小组同学欲用下图所示仪器及试剂制备并收集纯净、干燥的氯气。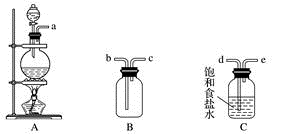
①用不到的仪器是(填大写字母)
②将各仪器按先后顺序连接起来,应该是:(用导管口处的字母表示)。
③浓盐酸与二氧化锰反应的离子方程式
④ C的作用 , D的作用 , E中倒置漏斗的作用是
(2)、该小组同学设计如下所示装置探究氯气的氧化性。
① 通少量Cl2时,G中的现象是 , 原因是(用化学方程式表示)
② H中的现象是。
③ 烧杯中NaOH溶液的作用是
16. 实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题: (1)、A、B两仪器的名称:A , B。(2)、洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2 , 则C、D中应分别放入下列溶液中的C;D。
(1)、A、B两仪器的名称:A , B。(2)、洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2 , 则C、D中应分别放入下列溶液中的C;D。①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4
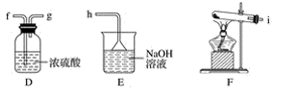
(3)、E 中为红色干布条,F 中为红色湿布条,可观察到的现象是。(4)、G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成。反应的离子方程式是 , H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成。(5)、P处为尾气吸收装置,可选用下列装置中的 。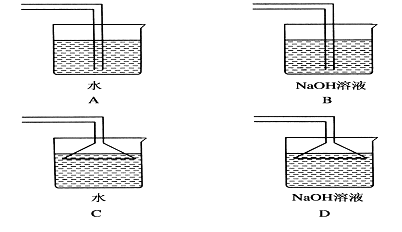
三、综合题
-
17. 氯气是一种重要的化工原料,它的发现和研究经历了以下几个阶段。(1)、1774 年,舍勒在研究软锰矿(主要成分是二氧化锰)时,将软锰矿与浓盐酸混合并加热,无意间制得了氯气,此反应中氯元素被(填“氧化”或“还原”)(2)、贝托莱发现,氯气能溶于水,向此溶液中滴加紫色石蕊溶液,观察到的现象是。(3)、泰纳将氯气通入石灰水,并一步步改进,制得了我们现在常用的漂白粉,漂白粉的有效成分是。(4)、盖吕萨克发现氯气能与金属反应。氯气与铝反应的化学方程式是。(5)、1810 年,戴维经过大量实验研究,确认氯气是一种单质,且有毒。实验室吸收氯气的常用方法是(用化学方程式表示)18. 如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
 (1)、装置C中盛装的溶液是 , D中试剂的作用是。(2)、写出F中反应的化学反应方程式: ,其反应现象为。(3)、H中的试剂为 , 用来吸收多余氯气。该反应的离子方程式为。19. 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示:
(1)、装置C中盛装的溶液是 , D中试剂的作用是。(2)、写出F中反应的化学反应方程式: ,其反应现象为。(3)、H中的试剂为 , 用来吸收多余氯气。该反应的离子方程式为。19. 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示: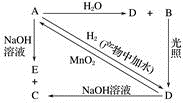 (1)、请分别写出下列物质的化学式(如为溶液请填溶质的化学式):A、B、D。(2)、写出下列反应的化学方程式或离子方程式(请注明反应条件):A+H2O(离子方程式):;A+NaOH(离子方程式):;D→A(化学方程式):。20. 某固体物质可能由K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列五步实验。观察到的现象如下:
(1)、请分别写出下列物质的化学式(如为溶液请填溶质的化学式):A、B、D。(2)、写出下列反应的化学方程式或离子方程式(请注明反应条件):A+H2O(离子方程式):;A+NaOH(离子方程式):;D→A(化学方程式):。20. 某固体物质可能由K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列五步实验。观察到的现象如下:①混合物加水得无色透明溶液;
②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④往一份滤液中滴加氯水并加入CCl4 , 振荡后静置CCl4层呈无色(氯水能将I-氧化为I2);
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
由此可推断出:
(1)、写出③中白色沉淀可完全溶于稀盐酸的离子方程式。(2)、写出⑤中生成白色沉淀的离子方程式。(3)、该固体中一定含有;无法确定是否含有的是。(4)、确定该物质是否存在的方法是。