山西省运城市芮城县2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2020-07-30 类型:期末考试
一、单选题
-
1. 中华民族为人类文明进步做出了巨大贡献。下列几个事例中运用化学知识对其进行的分析不合理的是( )A、“嫦娥四号”月球探测器中使用的碳纤维是一种新型有机高分子材料 B、四千余年前用谷物酿造出酒和醋,其变醋过程主要是酒发生了氧化反应 C、屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作 D、《本草纲目》中有如下记载:“(火药)乃焰硝(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用了KNO3的氧化性2. 下列有关物质的组成与分类正确的是( )A、空气中的碳、氮、硫的氧化物溶于雨水形成酸雨 B、石油是混合物,经过分馏可得汽油、柴油等纯净物 C、糖类、油脂、蛋白质均是由C、H、O三种元素组成 D、建设雷神山医院所用的PVC(聚氯乙烯)管道材料属于塑料制品3. 进行化学实验时应强化安全意识。下列做法正确的是( )A、金属钠着火时使用泡沫灭火器灭火 B、用试管加热碳酸氢钠固体时使试管口竖直向上 C、制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 D、浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗4. 2020年2月9日晚,湖北省新冠肺炎疫情防控指挥部的第19场新闻发布会上,华中科大公共卫生学院副院长徐顺清介绍,新型冠状病毒的主要传播途径有直接传播(飞沫传播)和接触传播,目前没有直接证据证明病毒通过气溶胶传播。下列说法错误的是( )A、云、烟、雾均属于气溶胶 B、可用渗析的方法除去胶体中存在的离子 C、胶体是混合物,可用丁达尔效应来鉴别胶体和溶液 D、PM2.5是对空气中直径小于或等于2.5μm(2.5×10-6m)的固体颗粒或液滴的总称,其分散在空气中一定形成气溶胶5. 下列实验操作正确的是( )A、滴定前用待测液润洗锥形瓶 B、容量瓶和滴定管使用前均需要检漏 C、蒸馏完毕时,先关闭冷凝水,再停止加热 D、分液时,上层溶液先从上口倒出,下层溶液再从下口放出6. NA代表阿伏加德罗常数的值。下列叙述正确的是( )A、92.0 g甘油(丙三醇)中含有羟基数为1.0NA B、标准状况下,2.24 L CCl4含有的共价键数为0.4NA C、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2.0NA D、0.2 mol冰醋酸与0.4 mol乙醇一定条件下充分反应,生成乙酸乙酯的分子数为0.2NA7. 下列关于有机化合物的说法错误的是( )A、制口罩的原料是聚丙烯,其分子式为(C3H6)n , 它能使溴水褪色 B、分子式为C4H10O并能与金属钠反应放出氢气的有机物(不含立体异构)有4种 C、在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 D、聚合物(
 )可由单体 CH2=CH2和CH3CH=CH2加聚制得
8. 实验室利用乙醇催化氧化法制取并提纯乙醛的实验过程中,下列装置未涉及的是( )A、
)可由单体 CH2=CH2和CH3CH=CH2加聚制得
8. 实验室利用乙醇催化氧化法制取并提纯乙醛的实验过程中,下列装置未涉及的是( )A、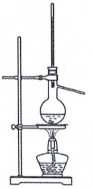 B、
B、 C、
C、 D、
D、 9. 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
9. 汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( ) A、该物质遇FeCl3溶液不显色 B、汉黄芩素的分子式为C16H12O5 C、1 mol该物质与溴水反应,最多消耗1 mol Br2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种10. 实验室利用反应:
A、该物质遇FeCl3溶液不显色 B、汉黄芩素的分子式为C16H12O5 C、1 mol该物质与溴水反应,最多消耗1 mol Br2 D、与足量H2发生加成反应后,该分子中官能团的种类减少1种10. 实验室利用反应:

 合成洋茉莉醛的流程如图所示。下列说法错误的是( )
合成洋茉莉醛的流程如图所示。下列说法错误的是( )  A、水洗的目的是除去KOH B、试剂X应选用有机溶剂 C、黄樟油素和异黄樟油素互为同分异构体 D、进行蒸馏操作时可选用球形冷凝管11. 75%的酒精、“84”消毒液、双氧水等化学品均是抗疫期间常用的消毒剂。下列有关“84”消毒液(NaClO和NaCl混合溶液)的叙述正确的是( )A、该溶液中,H+、 、 、I-可以大量共存 B、该溶液中,Ag+、K+、 、CH3CH2OH可以大量共存 C、向该溶液中加入浓盐酸,会产生黄绿色气体Cl2 D、向该溶液中滴入少量FeSO4溶液的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O12. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )A、上述实验中,共有两个氧化还原反应 B、上述实验证明氧化性: >Cl2>Fe3+>I2 C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 D、实验②证明Fe2+既有氧化性又有还原性13. 下列实验不能达到目的的是( )
A、水洗的目的是除去KOH B、试剂X应选用有机溶剂 C、黄樟油素和异黄樟油素互为同分异构体 D、进行蒸馏操作时可选用球形冷凝管11. 75%的酒精、“84”消毒液、双氧水等化学品均是抗疫期间常用的消毒剂。下列有关“84”消毒液(NaClO和NaCl混合溶液)的叙述正确的是( )A、该溶液中,H+、 、 、I-可以大量共存 B、该溶液中,Ag+、K+、 、CH3CH2OH可以大量共存 C、向该溶液中加入浓盐酸,会产生黄绿色气体Cl2 D、向该溶液中滴入少量FeSO4溶液的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O12. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )A、上述实验中,共有两个氧化还原反应 B、上述实验证明氧化性: >Cl2>Fe3+>I2 C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 D、实验②证明Fe2+既有氧化性又有还原性13. 下列实验不能达到目的的是( )选项
目的
实验
A
除去Na2CO3固体中的NaHCO3
将固体加热至恒重
B
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
C
除去乙酸乙酯中的少量乙酸
加入饱和碳酸钠溶液洗涤、分液
D
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
A、A B、B C、C D、D14. 交联聚合物P的结构片段如图所示。下列说法错误的是(图中 表示链延长)( )
表示链延长)( )  A、聚合物P中有酯基,能水解 B、聚合物P的合成反应为缩聚反应 C、聚合物P的原料之一丙三醇可由油脂水解获得 D、邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构15. 化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得
A、聚合物P中有酯基,能水解 B、聚合物P的合成反应为缩聚反应 C、聚合物P的原料之一丙三醇可由油脂水解获得 D、邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构15. 化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得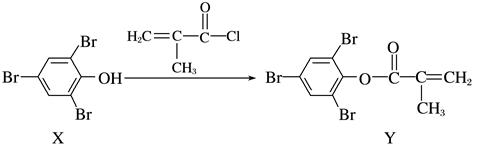
下列有关化合物X、Y的说法正确的是( )
A、X→Y的反应为加成反应 B、X分子中所有原子一定在同一平面上 C、X、Y均不能使酸性KMnO4溶液褪色 D、Y与Br2加成产物分子中含有手性碳原子16. 处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3−、ClO−、CNO−(C+4价,N-3价)、Cl−等微粒。下列说法错误的是( ) A、该废水呈强酸性 B、废水处理后转化为无害物质 C、反应的离子方程式:3ClO−+2CNO−+H2O = N2+2HCO3−+3Cl− D、每处理1 mol CNO−转移3 mol e−17. 探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
A、该废水呈强酸性 B、废水处理后转化为无害物质 C、反应的离子方程式:3ClO−+2CNO−+H2O = N2+2HCO3−+3Cl− D、每处理1 mol CNO−转移3 mol e−17. 探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)实验
装置
试剂a
现象
①

Ca(OH)2溶液(含酚酞)
溶液褪色,产生白色沉淀
②
少量NaHCO3溶液
产生气泡
③
酸性KMnO4溶液
紫色溶液褪色
④
C2H5OH和浓硫酸
加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式错误的是( )
A、H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O B、酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O C、H2C2O4具有还原性:2 +5 +16H+=2Mn2++10CO2↑+ 8H2O D、H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH C2H5OOCCOOC2H5+2H2O二、填空题
-
18. 现有四种有机化合物:
甲:
 乙:
乙: 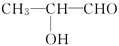 丙:
丙: 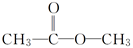 丁:
丁: 
试回答:
(1)、甲、乙、丁都含有的官能团的名称是 , 四种物质中互为同分异构体的是(填编号,下同)。(2)、1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是。(3)、丁与醋酸在催化剂作用下发生取代反应生成的酯有种。(4)、①写出甲与乙醇发生酯化反应的化学方程式:。②写出乙与新制氢氧化铜悬浊液反应的化学方程式:。
三、综合题
-
19. 铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强,必须进行处理。工业上往往采取下列循环工艺防止铬的污染:
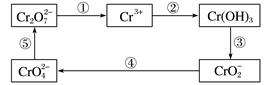 (1)、上述各步反应中属于氧化还原反应的是(填序号)。(2)、第①步,含 的废水在酸性条件下用绿矾FeSO4·7H2O处理,写出该反应的离子方程式:。(3)、第②步,向上述反应后的溶液中加入适量的碱石灰,使铬离子转变为Cr(OH)3沉淀。处理后,沉淀物中除了Cr(OH)3外,还有、(写化学式)。已知Cr(OH)3性质类似Al(OH)3 , 是既能与强酸反应又能与强碱反应的两性物质,从沉淀中分离出Cr(OH)3的流程如图:
(1)、上述各步反应中属于氧化还原反应的是(填序号)。(2)、第①步,含 的废水在酸性条件下用绿矾FeSO4·7H2O处理,写出该反应的离子方程式:。(3)、第②步,向上述反应后的溶液中加入适量的碱石灰,使铬离子转变为Cr(OH)3沉淀。处理后,沉淀物中除了Cr(OH)3外,还有、(写化学式)。已知Cr(OH)3性质类似Al(OH)3 , 是既能与强酸反应又能与强碱反应的两性物质,从沉淀中分离出Cr(OH)3的流程如图: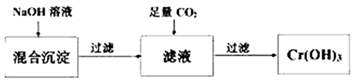
写出从该沉淀物中分离出Cr(OH)3的离子方程式、。
(4)、回收所得的Cr(OH)3 , 经③④⑤步处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① +6I-+14H+=3I2+2Cr3++7H2O
②2 +I2= +2I-
准确称取纯净的K2Cr2O7 0.1225g配成溶液,用上述方法滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为(保留四位有效数字)。
20. 2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如图:
已知:


回答下列问题:
(1)、 分子中不同化学环境的氢原子共有种,共面原子数目最多为。 (2)、写出⑧的反应试剂和条件;F中含氧官能团的名称为。(3)、该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是。(4)、写出⑥的化学反应方程式。(5)、B的名称为。写出符合下列条件B的所有同分异构体的结构简式。
分子中不同化学环境的氢原子共有种,共面原子数目最多为。 (2)、写出⑧的反应试剂和条件;F中含氧官能团的名称为。(3)、该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是。(4)、写出⑥的化学反应方程式。(5)、B的名称为。写出符合下列条件B的所有同分异构体的结构简式。a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(6)、请写出以 为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程。
为主要原料,经最少步骤制备含酰胺键(结构与肽键相同)聚合物的流程。  …… 目标化合物
…… 目标化合物 四、实验题
-
21. 二茂铁可用作燃料的节能消烟剂、抗爆剂等,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置示意图如图所示:

已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6 , 密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)、仪器c的名称是。和普通分液漏斗相比,使用恒压滴液漏斗a的优点是。(2)、步骤①中通入氮气的作用是。(3)、步骤⑤用盐酸洗涤的目的是。(4)、步骤⑦是二茂铁粗产品的提纯,该过程在如图装置中进行,其操作名称为;为了确认得到的是二茂铁,还需要进行的一项简单实验是; (5)、若最终制得纯净的二茂铁4.3 g,则该实验的产率为(保留小数点后一位)。
(5)、若最终制得纯净的二茂铁4.3 g,则该实验的产率为(保留小数点后一位)。
-