北京市房山区2019-2020学年高二下学期化学期末考试试卷
试卷更新日期:2020-07-30 类型:期末考试
一、单选题
-
1. 实施垃圾分类,节约使用资源是社会文明水平的重要体现,废旧铅蓄电池属于( )A、厨余垃圾
 B、可回收物
B、可回收物  C、有害垃圾
C、有害垃圾  D、其他垃圾
D、其他垃圾  2. 下列反应的能量变化符合图的是( )
2. 下列反应的能量变化符合图的是( ) A、CH4 燃烧 B、食物腐败变质 C、NaOH 溶液滴定 HCl 溶液 D、Ba(OH)2·8H2O与 NH4Cl 反应制冷3. 下列物质属于弱电解质的是( )A、NaCl B、NH3·H2O C、H2SO4 D、NaOH4. 下列电离方程式书写错误的是( )A、HCl =H++Cl- B、H2O OH-+H+ C、NH3·H2O +OH- D、NaHCO3=Na++H++5. 下列方法中,不能使醋酸溶液中 CH3COOH⇌CH3COO- +H+ 电离程度增大的是( )A、升高温度 B、加水稀释 C、加入少量醋酸钠固体 D、加入少量氢氧化钠固体6. 下列离子方程式中,属于水解反应的是( )A、HCOOH⇌HCOO-+ H+ B、HCO + H2O⇌H2CO3+ OH- C、NH3·H2O⇌NH + OH- D、HCO + H2O⇌CO + H3O+7. 在一定温度下的恒容密闭容器中发生反应:2SO2(g) + O2(g)⇌2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )A、c(SO2):c(O2):c(SO3) = 2:1:2 B、容器内的压强不再改变 C、SO2 的转化率不再改变 D、SO3 的生成速率与 SO3 的消耗速率相等8. 对于处于化学平衡状态的反应2SO2(g) + O2(g)⇌2SO3(g)DH=-197 kJ/mol既要提高反应速率又要提高SO2 的转化率,下列措施中可行的是( )A、减小SO3浓度 B、增大体系压强 C、升高温度 D、使用合适的催化剂9. 难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的( )A、溶液中不存在难溶电解质离子 B、沉淀的速率和溶解的速率相等 C、继续加入难溶电解质,溶液中各离子浓度不变 D、一定条件下可以转化为更难溶的物质10. 下列与电化学相关的叙述中正确的是( )A、原电池中正极发生氧化反应 B、电解池中与电源负极相连的是阳极 C、电镀液中应含有镀层金属阳离子 D、电解氯化钠溶液可制备金属钠11. 锌铜原电池装置如图所示,下列说法错误的是( )
A、CH4 燃烧 B、食物腐败变质 C、NaOH 溶液滴定 HCl 溶液 D、Ba(OH)2·8H2O与 NH4Cl 反应制冷3. 下列物质属于弱电解质的是( )A、NaCl B、NH3·H2O C、H2SO4 D、NaOH4. 下列电离方程式书写错误的是( )A、HCl =H++Cl- B、H2O OH-+H+ C、NH3·H2O +OH- D、NaHCO3=Na++H++5. 下列方法中,不能使醋酸溶液中 CH3COOH⇌CH3COO- +H+ 电离程度增大的是( )A、升高温度 B、加水稀释 C、加入少量醋酸钠固体 D、加入少量氢氧化钠固体6. 下列离子方程式中,属于水解反应的是( )A、HCOOH⇌HCOO-+ H+ B、HCO + H2O⇌H2CO3+ OH- C、NH3·H2O⇌NH + OH- D、HCO + H2O⇌CO + H3O+7. 在一定温度下的恒容密闭容器中发生反应:2SO2(g) + O2(g)⇌2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )A、c(SO2):c(O2):c(SO3) = 2:1:2 B、容器内的压强不再改变 C、SO2 的转化率不再改变 D、SO3 的生成速率与 SO3 的消耗速率相等8. 对于处于化学平衡状态的反应2SO2(g) + O2(g)⇌2SO3(g)DH=-197 kJ/mol既要提高反应速率又要提高SO2 的转化率,下列措施中可行的是( )A、减小SO3浓度 B、增大体系压强 C、升高温度 D、使用合适的催化剂9. 难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的( )A、溶液中不存在难溶电解质离子 B、沉淀的速率和溶解的速率相等 C、继续加入难溶电解质,溶液中各离子浓度不变 D、一定条件下可以转化为更难溶的物质10. 下列与电化学相关的叙述中正确的是( )A、原电池中正极发生氧化反应 B、电解池中与电源负极相连的是阳极 C、电镀液中应含有镀层金属阳离子 D、电解氯化钠溶液可制备金属钠11. 锌铜原电池装置如图所示,下列说法错误的是( ) A、电子从锌片流向铜片 B、盐桥中 K+向负极移动 C、锌电极上发生的反应:Zn − 2e- =Zn2+ D、该装置实现了氧化反应和还原反应分开进行12. 已知:2SO2(g) + O2(g)⇌2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中错误的是( )
A、电子从锌片流向铜片 B、盐桥中 K+向负极移动 C、锌电极上发生的反应:Zn − 2e- =Zn2+ D、该装置实现了氧化反应和还原反应分开进行12. 已知:2SO2(g) + O2(g)⇌2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中错误的是( ) A、反应的 ΔH<0 B、过程b 使用了催化剂 C、过程b 发生两步反应,第一步为吸热反应 D、使用催化剂可以降低反应活化能,提高 SO2 的平衡转化率13. 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:HUr(aq) + Na+ (aq)⇌NaUr(s) + H+(aq)ΔH<0,下列说法错误的是( )A、炎热的夏季更易诱发关节疼痛 B、饮食中摄入过多食盐,会加重痛风病病情 C、患痛风病的人应少吃能代谢产生更多尿酸(HUr)的食物 D、大量饮水使 增大,痛风病发作的可能性减小14. CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH=+247 kJ·mol−1 , 同时存在以下反应:积碳反应:CH4(g)⇌C(s)+2H2(g) ΔH=+75 kJ·mol−1 , 消碳反应:CO2(g)+C(s)⇌2CO(g) ΔH=+172 kJ·mol−1 , 积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图。下列说法正确的是( )
A、反应的 ΔH<0 B、过程b 使用了催化剂 C、过程b 发生两步反应,第一步为吸热反应 D、使用催化剂可以降低反应活化能,提高 SO2 的平衡转化率13. 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:HUr(aq) + Na+ (aq)⇌NaUr(s) + H+(aq)ΔH<0,下列说法错误的是( )A、炎热的夏季更易诱发关节疼痛 B、饮食中摄入过多食盐,会加重痛风病病情 C、患痛风病的人应少吃能代谢产生更多尿酸(HUr)的食物 D、大量饮水使 增大,痛风病发作的可能性减小14. CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH=+247 kJ·mol−1 , 同时存在以下反应:积碳反应:CH4(g)⇌C(s)+2H2(g) ΔH=+75 kJ·mol−1 , 消碳反应:CO2(g)+C(s)⇌2CO(g) ΔH=+172 kJ·mol−1 , 积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图。下列说法正确的是( ) A、高压利于提高 CH4 的平衡转化率并减少积碳 B、增大CO2与CH4的物质的量之比有助于减少积碳 C、升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大 D、温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快, 积碳量减少15. 为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。下列说法错误的是( )
A、高压利于提高 CH4 的平衡转化率并减少积碳 B、增大CO2与CH4的物质的量之比有助于减少积碳 C、升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大 D、温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快, 积碳量减少15. 为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。下列说法错误的是( ) A、CO2过量排放是导致温室效应的原因之一 B、过程②中C2O52-在a极上发生了还原反应 C、过程③中的反应可表示为:CO2+O2-=CO32- D、CO2最终转化为C和O216. 探究浓度对2Fe3+ + 2I-⇌2Fe2+ + I2 的影响,进行如下实验:
A、CO2过量排放是导致温室效应的原因之一 B、过程②中C2O52-在a极上发生了还原反应 C、过程③中的反应可表示为:CO2+O2-=CO32- D、CO2最终转化为C和O216. 探究浓度对2Fe3+ + 2I-⇌2Fe2+ + I2 的影响,进行如下实验:
下列说法错误的是( )
A、Ⅱ中加入的 SCN-结合Fe3+使平衡向左移动 B、Ⅲ中含有 I2 C、比较水溶液中的 c(I-):II>Ⅳ D、比较水溶液中的 c(Fe3+):Ⅳ>I二、填空题
-
17. 回答下面问题:(1)、在①KNO3 ②K2CO3 ③(NH4)2SO4 三种盐溶液中,常温下呈酸性的是(填序号),显酸性的原因是(用化学用语表示)。(2)、将三氯化锑(SbCl3)固体溶于水,生成白色沉淀,且溶液 pH<7,则配制 SbCl3 溶液的正确方法是(3)、某温度下,向含有 AgCl 固体的 AgCl 饱和溶液中加入少量稀盐酸,则 c(Ag+)(填“增大”“减小”或“不变”,下同),Ksp。18. 工业合成氨技术反应原理为:N2 (g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1(1)、T ℃ 时,反应达到平衡,测得 υ(NH3)=0.12 mol·L-1·min -1
① υ(N2)=mol·L-1·min -1
② 化学平衡常数表达式 K=
(2)、在其他条件相同时,图为分别测定不同压强、不同温度下,N2 的平衡转化率。
L 表示 , 其中 X1 X2(填“>”或“<)
三、实验题
-
19. 某学习小组为了探究CH3COOH的电离情况,进行了如下实验。(1)、(实验一)测定醋酸溶液中CH3COOH的物质的量浓度。
用 0.2000mol/L 的 NaOH 溶液滴定 20.00mL 醋酸溶液,3 次滴定所消耗NaOH溶液的体积如下:
实验次数
1
2
3
消耗NaOH 溶液的体积/mL
20.05
20.00
19.95
量取 20.00 mL 醋酸溶液所用的仪器是(填字母)


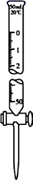

a
b
c
d
(2)、以上醋酸溶液中CH3COOH的物质的量浓度为(3)、(实验二)探究浓度对CH3COOH电离程度的影响。用 pH 计测定 25℃时不同浓度的醋酸的 pH,结果如下:
浓度/(mol·L-1)
0.2000
0.1000
0.0100
pH
2.83
2.88
3.38
根据表中数据可知CH3COOH是电解质(填“强”或“弱”) 得出此结论的依据是
(4)、写出CH3COOH的电离方程式四、综合题
-
20. 偏二甲肼(C2H8N2)与 N2O4 是常用的火箭推进剂,常温下,1mol 液态 C2H8N2与 2mol 液态 N2O4 完全反应,生成 CO2、N2、H2O 三种无污染气体的同时释放出高达 2250kJ 的热量。(1)、偏二甲肼与 N2O4 反应的热化学方程式为(2)、反应中的氧化剂是(3)、火箭发射时常出现红棕色气体,原因为:N2O4⇌2NO2 当温度升高时,气体颜色变深,则该反应为热反应(填“吸”或“放”)(4)、现将 1mol N2O4 充入一个恒容密闭容器中,下列示意图正确且能说明 N2O4⇌2NO2达到平衡状态的是(填字母)
 (5)、在研究之初,科学家曾考虑将氧化性更强的F2或反应速率极快、释放能量更高的N5 用作推进剂,但综合分析后均未采用,请分析火箭推进剂应具备的特点是21. 电化学原理被广泛地应用于生产、生活的许多方面。(1)、I.制备氯气
(5)、在研究之初,科学家曾考虑将氧化性更强的F2或反应速率极快、释放能量更高的N5 用作推进剂,但综合分析后均未采用,请分析火箭推进剂应具备的特点是21. 电化学原理被广泛地应用于生产、生活的许多方面。(1)、I.制备氯气工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

此过程中能量转化形式为转化为(填“化学能”或“电能”)
(2)、电极乙为(填“阴极”或“阳极”),A 口生成的气体是(3)、电解饱和食盐水的离子方程式是(4)、下列有关氯气的说法中正确的是a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
(5)、II.金属防护某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)
(6)、结合电极反应式解释 i 中现象产生的原因(7)、结合以上实验,请对铁制零件的使用提出建议
-