江苏省七市(南通、泰州、扬州、徐州、淮安、连云港、宿迁)2020年高考化学6月模拟试卷
试卷更新日期:2020-07-30 类型:高考模拟
一、单选题
-
1. 糖类、油脂、蛋白质是生产生活中的重要物质。下列有关说法错误的是( )A、淀粉在人体内水解的最终产物为葡萄糖 B、油脂属于酯类,可用于制取肥皂 C、蛋白质的基本结构单元是氨基酸 D、糖类、油脂、蛋白质中均只含有碳、氢、氧三种元素2. 反应CH3CH2CH2OH CH3CH=CH2↑+H2O可用于制备丙烯。下列表示反应中相关微粒的化学用语正确的是( )A、中子数为10的氧原子: B、硫原子的结构示意图:
 C、聚丙烯的结构简式:
C、聚丙烯的结构简式:  D、H2O的电子式:
D、H2O的电子式:  3. 下列有关物质的性质与用途具有对应关系的是( )A、MgCl2易溶于水,可用于电解冶炼镁 B、ClO2具有强氧化性,可用于自来水的杀菌消毒 C、溴水呈橙黄色,可用于除去CH4中混有的C2H4 D、浓硫酸具有腐蚀性,可用于催化乙酸和乙醇的反应4. FeCl3溶液常用于蚀刻电路板,蚀刻后的酸性溶液中含有Cu2+、Fe2+、Fe3+、Cl-等。下列各组离子能在该酸性溶液中大量共存的是( )A、Na+、Al3+、Cl-、SO42- B、Ca2+、Mg2+、NO3-、ClO- C、K+、NH 、SO32-、AlO2- D、Ba2+、K+、I-、NO3-5. 用下列装置进行相应的实验,不能达到实验目的的是( )A、
3. 下列有关物质的性质与用途具有对应关系的是( )A、MgCl2易溶于水,可用于电解冶炼镁 B、ClO2具有强氧化性,可用于自来水的杀菌消毒 C、溴水呈橙黄色,可用于除去CH4中混有的C2H4 D、浓硫酸具有腐蚀性,可用于催化乙酸和乙醇的反应4. FeCl3溶液常用于蚀刻电路板,蚀刻后的酸性溶液中含有Cu2+、Fe2+、Fe3+、Cl-等。下列各组离子能在该酸性溶液中大量共存的是( )A、Na+、Al3+、Cl-、SO42- B、Ca2+、Mg2+、NO3-、ClO- C、K+、NH 、SO32-、AlO2- D、Ba2+、K+、I-、NO3-5. 用下列装置进行相应的实验,不能达到实验目的的是( )A、 用图甲装置验证NH3易溶于水
B、
用图甲装置验证NH3易溶于水
B、 用图乙装置提纯I2
C、
用图乙装置提纯I2
C、 用图丙装置测定KMnO4溶液物质的量浓度(锥形瓶中Na2C2O4质量已知)
D、
用图丙装置测定KMnO4溶液物质的量浓度(锥形瓶中Na2C2O4质量已知)
D、 用图丁装置检验该条件下铁发生了析氢腐蚀
6. 借助锂循环可实现氨的常压合成,其原理如图所示。下列说法错误的是( )
用图丁装置检验该条件下铁发生了析氢腐蚀
6. 借助锂循环可实现氨的常压合成,其原理如图所示。下列说法错误的是( ) A、“STEP1”金属锂在阳极生成 B、“STEP2”的反应属于氮的固定 C、“STEP3”发生的反应为复分解反应 D、循环过程中存在3种以上形式的能量转化7. 下列指定反应的离子方程式正确的是( )A、Na与水反应:Na+2H2O=Na++2OH-+H2↑ B、用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O C、用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O D、NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X与W同主族,Y原子的最外层电子数是其内层电子数的3倍,0.1 mol Z单质与足量盐酸反应产生H2的体积为3.36 L(折算成标准状况),W在元素周期表中的主族序数比其周期数大1。下列说法正确的是( )A、XY2属于离子化合物 B、X的一种单质在高温下与WY2反应可制得W单质 C、原子半径:r(Z)>r(W)>r(Y)>r(X) D、W的简单气态氢化物的热稳定性比Y的强9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、S SO2 CaSO3 B、Si SiO2 SiCl4 C、Cu Cu(OH)2 Cu2O D、
A、“STEP1”金属锂在阳极生成 B、“STEP2”的反应属于氮的固定 C、“STEP3”发生的反应为复分解反应 D、循环过程中存在3种以上形式的能量转化7. 下列指定反应的离子方程式正确的是( )A、Na与水反应:Na+2H2O=Na++2OH-+H2↑ B、用NaOH溶液吸收NO2:2NO2+Na++2OH-=NaNO3+NO2-+H2O C、用MnO2和浓盐酸反应制备Cl2:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O D、NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X与W同主族,Y原子的最外层电子数是其内层电子数的3倍,0.1 mol Z单质与足量盐酸反应产生H2的体积为3.36 L(折算成标准状况),W在元素周期表中的主族序数比其周期数大1。下列说法正确的是( )A、XY2属于离子化合物 B、X的一种单质在高温下与WY2反应可制得W单质 C、原子半径:r(Z)>r(W)>r(Y)>r(X) D、W的简单气态氢化物的热稳定性比Y的强9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、S SO2 CaSO3 B、Si SiO2 SiCl4 C、Cu Cu(OH)2 Cu2O D、

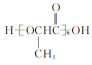 10. 根据下列图示所得出的结论正确的是( )A、
10. 根据下列图示所得出的结论正确的是( )A、 图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
B、
图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S
B、 图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg 的变化关系,则a=2
C、
图乙表示V0 mL 0.1 mol·L-1的盐酸加水稀释至V mL,溶液的pH随lg 的变化关系,则a=2
C、 图丙表示密闭容器中CH4(g)+H2O(g) CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
D、
图丙表示密闭容器中CH4(g)+H2O(g) CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,说明p1>p2
D、 图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
11. N2H4、N2O4常用作火箭发射的推进剂。推进剂发生反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)。下列有关说法正确的是( )A、反应每生成0.3 mol N2 , 转移电子的数目为1.6×6.02×1023 B、充有N2O4的密闭容器中存在:N2O4(g) 2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度 C、碱性N2H4—空气燃料电池工作时,正极电极反应式为O2+2H2O+4e-=4OH- D、N2H4的水溶液中存在:N2H4+H2O N2H +OH- , 向稀溶液中加水稀释, 的值变大12. 根据下列实验操作和现象所得出的结论正确的是( )
图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29 eV的能量
11. N2H4、N2O4常用作火箭发射的推进剂。推进剂发生反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)。下列有关说法正确的是( )A、反应每生成0.3 mol N2 , 转移电子的数目为1.6×6.02×1023 B、充有N2O4的密闭容器中存在:N2O4(g) 2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度 C、碱性N2H4—空气燃料电池工作时,正极电极反应式为O2+2H2O+4e-=4OH- D、N2H4的水溶液中存在:N2H4+H2O N2H +OH- , 向稀溶液中加水稀释, 的值变大12. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
将石蜡油分解产生的气体通入酸性高锰酸钾溶液中,溶液的紫红色逐渐变浅
石蜡油分解产生的气体中含有乙烯
B
向装有Na2CO3、NaHCO3固体的两支试管中分别加入10 mL蒸馏水,并将其置于20 ℃水浴中,最终发现只有NaHCO3未完全溶解
20 ℃时,溶解度:Na2CO3>NaHCO3
C
向盛有5 mL 0.005 mol·L-1FeCl3溶液中加入 5 mL 0.015 mol·L-1KSCN溶液,溶液变红,再加入少量铁粉,溶液颜色变浅
加入铁粉后,Fe3++3SCN-⇌Fe(SCN)3向逆反应方向移动
D
向鸡蛋清溶液中加入2滴1%的醋酸铅溶液,产生白色沉淀,向沉淀中加入蒸馏水,沉淀不溶解
醋酸铅能使蛋白质发生盐析
A、A B、B C、C D、D二、多选题
-
13. 苋菜甲素、3-丁烯基苯酞、藁本内酯是传统中药当归、川芎中的活性成分。下列有关说法正确的是( )
 A、苋菜甲素、藁本内酯互为同分异构体 B、1 mol 3-丁烯基苯酞与溴水反应最多消耗4 mol Br2 C、3-丁烯基苯酞通过还原反应可制得苋菜甲素 D、藁本内酯与足量H2加成的产物分子中含有2个手性碳原子14. 亚砷酸(H3AsO3)可用于白血病的治疗。室温下,配制一组c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)=0.100 mol·L-1的H3AsO3和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化关系曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是( )
A、苋菜甲素、藁本内酯互为同分异构体 B、1 mol 3-丁烯基苯酞与溴水反应最多消耗4 mol Br2 C、3-丁烯基苯酞通过还原反应可制得苋菜甲素 D、藁本内酯与足量H2加成的产物分子中含有2个手性碳原子14. 亚砷酸(H3AsO3)可用于白血病的治疗。室温下,配制一组c(H3AsO3)+c(H2AsO3-)+c(HAsO32-)+c(AsO33-)=0.100 mol·L-1的H3AsO3和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化关系曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是( ) A、pH=11的溶液中:c(HAsO32-)+c(AsO33-)>c(H2AsO3-) B、c(Na+)=0.100 mol·L-1的溶液中:c(H2AsO3-)>c(H3AsO3)>c(HAsO32-) C、c(Na+)=0.200 mol·L-1的溶液中:c(H+)+2c(H3AsO3)=c(OH-)+c(AsO33-) D、pH=12.8的溶液中:c(H+)+c(Na+)>4c(H2AsO3-)+c(HAsO32-)+c(OH-)15. 烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g) NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3 , 测得NO的体积分数随时间的变化如图所示。下列说法正确的是( )
A、pH=11的溶液中:c(HAsO32-)+c(AsO33-)>c(H2AsO3-) B、c(Na+)=0.100 mol·L-1的溶液中:c(H2AsO3-)>c(H3AsO3)>c(HAsO32-) C、c(Na+)=0.200 mol·L-1的溶液中:c(H+)+2c(H3AsO3)=c(OH-)+c(AsO33-) D、pH=12.8的溶液中:c(H+)+c(Na+)>4c(H2AsO3-)+c(HAsO32-)+c(OH-)15. 烟气中的NO经过O3预处理,再用CaSO3悬浊液吸收去除。预处理时发生反应:NO(g)+O3(g) NO2(g)+O2(g)。测得:v正=k正c(NO)·c(O3),v逆=k逆c(NO2)·c(O2),k正、k逆为速率常数,受温度影响。向容积均为2L的甲、乙两个密闭容器中充入一定量的NO和O3 , 测得NO的体积分数随时间的变化如图所示。下列说法正确的是( ) A、高温有利于提高容器中NO的平衡转化率 B、T1时,反应在t1min内的平均速率v(O2)= mol·L-1·min-1 C、T1时,NO(g)+O3(g) NO2(g)+O2(g)的k正>3k逆 D、T2时,向2L密闭容器中充入0.6molNO、0.4molO3 , 到达平衡时c(NO2)小于乙容器中平衡时c(NO2)
A、高温有利于提高容器中NO的平衡转化率 B、T1时,反应在t1min内的平均速率v(O2)= mol·L-1·min-1 C、T1时,NO(g)+O3(g) NO2(g)+O2(g)的k正>3k逆 D、T2时,向2L密闭容器中充入0.6molNO、0.4molO3 , 到达平衡时c(NO2)小于乙容器中平衡时c(NO2)三、工业流程
-
16. 以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4 , 含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。
 (1)、“除铝”时反应的离子方程式为。(2)、试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:。(3)、“浸取”所得滤液中,磷元素的存在形式主要是(填字母)。
(1)、“除铝”时反应的离子方程式为。(2)、试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:。(3)、“浸取”所得滤液中,磷元素的存在形式主要是(填字母)。a. PO b. H3PO4 c. H2PO
(4)、“沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是。 (5)、“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是。(6)、LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:。17. 实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
(5)、“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是。(6)、LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:。17. 实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4 , 另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
金属离子
开始沉淀的pH
完全沉淀的pH
Co2+
7.6
9.4
Zn2+
5.9
8.9
(1)、“酸浸”时所加稀硫酸不宜过量太多的原因是。(2)、“除铁”时,向溶液中持续鼓入空气的作用是。(3)、流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是。(4)、写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:。(5)、实验所得CoSO4溶液可用于制备CoCO3 , 制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为。(6)、请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液, , 过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
四、推断题
-
18. 化合物F是一种药物中间体,可以通过以下方法合成:
 (1)、C中的含氧官能团名称为和。(2)、E F的反应类型为。(3)、试剂X的分子式为C5H13N3 , 写出X的结构简式:。(4)、A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
(1)、C中的含氧官能团名称为和。(2)、E F的反应类型为。(3)、试剂X的分子式为C5H13N3 , 写出X的结构简式:。(4)、A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①能与FeCl3溶液发生显色反应;② 分子中只有4种不同化学环境的氢。
(5)、写出以CH3CH=CHCH3、HCHO及CH3COCH3为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 五、综合题
-
19. 草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}易溶于水,难溶于乙醇,110 ℃可完全失去结晶水,是制备某些铁触媒的主要原料。实验室通过下列方法制备Ka[Fe(C2O4)b]·cH2O并测定其组成:(1)、Ⅰ.草酸合铁酸钾晶体的制备

“转化”过程中若条件控制不当,会发生H2O2氧化H2C2O4的副反应,写出该副反应的化学方程式:。
(2)、“操作X”中加入乙醇的目的是。(3)、Ⅱ. 草酸合铁酸钾组成的测定步骤1:准确称取两份质量均为0.4910 g的草酸合铁酸钾样品。
步骤2:一份在N2氛围下保持110℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱,发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl- , 用蒸馏水冲洗交换柱,收集交换出的Cl- , 以K2CrO4为指示剂,用0.1500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量(填“偏大”“偏小”或“不变”)。
(4)、通过计算确定草酸合铁酸钾样品的化学式(写出计算过程)。20. 氢气是一种清洁能源,它的制取与应用一直是人类研究的热点。(1)、用甲醇和水蒸气在催化剂、加热条件下制氢的相关热化学方程式如下:CH3OH(g)=CO(g)+2H2(g);ΔH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ/mol
①反应CH3OH(g)+H2O(g) CO2(g)+3H2(g)能自发进行的原因是。
②将一定比例的CH3OH(g)和H2O(g)的混合气体,以相同速率通过装有不同催化剂的反应器。CH3OH转化率随催化剂的使用时长变化如图1所示,催化剂CuAl2O4与催化剂Cu/Zn/Al相比,优点有。

③向Cu(NO3)2、Al(NO3)3混合溶液中滴加NaOH溶液可获得沉淀物[Cu(OH)2、Al(OH)3],以便于制取CuAl2O4。为确保Cu2+、Al3+完全沉淀(浓度≤10-5 mol/L),应控制混合液pH的最小整数值为{Ksp[Cu(OH)2]=2.2×10-20 , Ksp[Al(OH)3]=1.3×10-33}。
(2)、用Au/ZrO2作催化剂,在(CH3CH2)3N作用下HCOOH分解制氢的原理如图2所示。反应2中生成物M的化学式为 , 图示反应中只有氢元素化合价发生变化的是反应(填“1”“2”或“3”)。(3)、如图是电解氨水和KOH混合溶液制氢的装置示意图。生成N2的电极反应式为。 (4)、富氧条件下,H2还原NOx包括两个阶段:第一阶段为H2、NOx在催化剂作用下转变为H2O、N2、NH3;第二阶段NH3在载体酸的作用下生成NH4+ , NH4+将NOx还原为N2。写出NO与O2的物质的量之比为1∶1时,NH4+与NO、O2反应生成N2的离子反应方程式:。21. K2Cr2O7是一种强氧化剂,在酸性条件下与乙醇发生如下反应: 3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(4)、富氧条件下,H2还原NOx包括两个阶段:第一阶段为H2、NOx在催化剂作用下转变为H2O、N2、NH3;第二阶段NH3在载体酸的作用下生成NH4+ , NH4+将NOx还原为N2。写出NO与O2的物质的量之比为1∶1时,NH4+与NO、O2反应生成N2的离子反应方程式:。21. K2Cr2O7是一种强氧化剂,在酸性条件下与乙醇发生如下反应: 3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O (1)、Cr基态核外电子排布式为。(2)、K、S、O三种元素的第一电离能由大到小的顺序为。(3)、乙醇的沸点比甲醚(CH3OCH3)的高,主要原因是。与H2O空间结构相同的一种阴离子为(填化学式)。(4)、[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为。(5)、某铬铝合金是一种轻质高温材料,其晶胞结构如图所示,该晶体中n(Cr)∶n(Al)=。
(1)、Cr基态核外电子排布式为。(2)、K、S、O三种元素的第一电离能由大到小的顺序为。(3)、乙醇的沸点比甲醚(CH3OCH3)的高,主要原因是。与H2O空间结构相同的一种阴离子为(填化学式)。(4)、[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为。(5)、某铬铝合金是一种轻质高温材料,其晶胞结构如图所示,该晶体中n(Cr)∶n(Al)=。六、实验题
-
22. 乙酸正丁酯(CH3CH2CH2CH2OOCCH3)是一种优良的有机溶剂。实验室制备少量乙酸正丁酯的反应为CH3COOH+CH3CH2CH2CH2OH CH3CH2CH2CH2OOCCH3+H2O。
实验步骤如下:
步骤1:向仪器A中加入11.5 mL正丁醇(微溶于水)、1 mL浓H2SO4、7.2 mL冰醋酸及沸石少许。
步骤2:按如图连接装置。

步骤3:向分水器中预先加少量水(略低于支管口)。通入冷却水,加热回流。
步骤4:将分水器分出的酯层和反应液合并转入分液漏斗中,依次用5% Na2CO3溶液、水洗涤,分离出有机相。
步骤5:将有机相用无水硫酸镁干燥、过滤、蒸馏,收集乙酸正丁酯。
(1)、仪器A的名称是;向其中加入碎瓷片的目的是。(2)、装置中分水器的作用是 , 判断反应已经完成的标志是。(3)、反应时生成的主要有机副产物有丁醚和(用结构简式表示)。(4)、步骤4中,分离出有机相的具体操作是。
-