福建省漳州市2020年高考化学三模试卷
试卷更新日期:2020-07-30 类型:高考模拟
一、单选题
-
1. 2019年12月以来,我国部分地区突发了“新型冠状病毒肺炎”疫情。以下是人们的一些认识,你认为不符合科学道理的是( )A、火神山医院在建造过程中大量使用HDPE防渗膜,这种塑料膜是一种新型的无机材料 B、84消毒液和75%的酒精是经常使用的消毒液,它们都可以使蛋白质变性 C、佩戴医用口罩预防病毒的原理相当于化学实验中的过滤 D、《新型冠状病毒肺炎诊疗方案》第六版增加“新型冠状病毒在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能。”此处气溶胶中的分散剂是空气2. 天津大学研制了一种纳米 反应器用于催化草酸二甲酯(DMO)和氢气反应获得EG,反应过程示意图如下,下列说法正确的是( )

 A、EG和乙醇是同系物 B、MG分子中所有原子可能在同一平面上 C、DMO分子中只有碳氧单键发生了断裂 D、反应过程中生成了EG和甲醇3. 下列关于有机物的说法正确的是( )A、将淀粉水解并检验其产物,加液顺序为:淀粉溶液→稀硫酸→新制的 悬浊液 B、 能发生酯化、加聚、水解等反应 C、
A、EG和乙醇是同系物 B、MG分子中所有原子可能在同一平面上 C、DMO分子中只有碳氧单键发生了断裂 D、反应过程中生成了EG和甲醇3. 下列关于有机物的说法正确的是( )A、将淀粉水解并检验其产物,加液顺序为:淀粉溶液→稀硫酸→新制的 悬浊液 B、 能发生酯化、加聚、水解等反应 C、 是重要有机化工产
是重要有机化工产 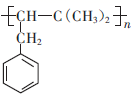 的单体
D、二环[1,1,0]丁烷(
的单体
D、二环[1,1,0]丁烷(  )的分子式为 ,其二氯代物有3种(不考虑立体异构)
4. 下列四套装置用于实验室制取二氧化硫并回收胆矾,其中不能达到实验目的的是( )A、制取二氧化硫
)的分子式为 ,其二氯代物有3种(不考虑立体异构)
4. 下列四套装置用于实验室制取二氧化硫并回收胆矾,其中不能达到实验目的的是( )A、制取二氧化硫 B、吸收尾气中的二氧化硫
B、吸收尾气中的二氧化硫  C、溶解反应后烧瓶内混合物中的硫酸铜固体
C、溶解反应后烧瓶内混合物中的硫酸铜固体  D、加热硫酸铜溶液制备胆矾
D、加热硫酸铜溶液制备胆矾  5. 短周期元素W、X、Y、Z的原子序数依次增大。其中Y与Z为金属元素,p、q是它们中的部分元素组成的化合物,r是W的单质。s是Z的单质,能溶解于Y的最高价氧化物的水化物溶液中。这些物质间的转化关系为 。下列说法正确的是( )A、q只含有共价键 B、原子半径:X<W<Z<Y C、W的最简单氢化物的热稳定性比X的强 D、Y分别与W、X形成的化合物都能使紫色石蕊溶液最终变蓝6. 某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
5. 短周期元素W、X、Y、Z的原子序数依次增大。其中Y与Z为金属元素,p、q是它们中的部分元素组成的化合物,r是W的单质。s是Z的单质,能溶解于Y的最高价氧化物的水化物溶液中。这些物质间的转化关系为 。下列说法正确的是( )A、q只含有共价键 B、原子半径:X<W<Z<Y C、W的最简单氢化物的热稳定性比X的强 D、Y分别与W、X形成的化合物都能使紫色石蕊溶液最终变蓝6. 某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
下列说法中,正确的是( )
A、充电时, 移向Zn膜 B、充电时,含有 膜的碳纳米管纤维一端连接有机高聚物电源负极 C、放电时,电子由锌膜表面经有机高聚物至 膜表面 D、放电时,电池的负极反应为:7. 25℃时,向 溶液中逐滴加入 的盐酸,溶液中 、HCN浓度所占分数( )随pH变化的关系如图甲所示,pH变化曲线如图乙所示。下列说法错误的是( )
 A、图甲中 的溶液: B、 C、图乙中b点的溶液: D、图乙中c点的溶液:
A、图甲中 的溶液: B、 C、图乙中b点的溶液: D、图乙中c点的溶液:二、实验题
-
8. 无水三氯化铬 在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用 和 在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
实验原理:
已知:① 熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
② 沸点为57.6℃;
③在碱性条件下, 能把 氧化为 ;
在酸性条件下, 能把 还原为 。
回答下列问题:
(1)、Ⅰ.氮气的制备利用工业氮气(混有 、 、 )制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→。
 (2)、Ⅱ.无水三氯化铬的制备
(2)、Ⅱ.无水三氯化铬的制备实验装置如图2所示(加热、夹持等装置已略去)。

通入 的作用是(写出2点)。
(3)、装置A和装置C的烧杯中分别盛放、。(4)、制备 时生成的气体 (俗称光气)有毒, 遇水发生水解,反应方程式为 。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为。(5)、图2装置中有设计不合理的地方,你认为应该改进的措施有。(6)、Ⅲ.产品中 质量分数的测定a.称取 产品,在强碱性条件下,加入过量的30% 溶液,小火加热使 完全转化为 ,继续加热一段时间;
b.冷却后加适量的蒸馏水,再滴入适量的浓 和浓 ,使 转化为 ;
c.用新配制的 硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理: ),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
回答下列问题:
①上述操作a中“继续加热一段时间”的目的是。
②加浓 的目的是为了防止指示剂提前变色。若不加浓 ,则测得的 的质量分数将(填“偏低”、“偏高”或“不变”)。
③产品中 的质量分数为%(保留一位小数)。
三、工业流程
-
9. 马日夫盐 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为 及少量的FeO、 和 )为原料制备马日夫盐的主要工艺流程如图:
 (1)、“浸锰”过程中,FeO参与氧化还原反应的离子方程式为。(2)、 的萃取率与溶液的pH的关系如图所示,当 时, 的萃取率急剧下降的原因可能为(用化学用语表示)。
(1)、“浸锰”过程中,FeO参与氧化还原反应的离子方程式为。(2)、 的萃取率与溶液的pH的关系如图所示,当 时, 的萃取率急剧下降的原因可能为(用化学用语表示)。 (3)、“调pH”的最大范围为。
(3)、“调pH”的最大范围为。金属离子
开始沉淀的pH
完全沉淀的pH
l. 8
3.2
3.0
5.0
5.8
8.8
7.8
9.8
(4)、如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备 ,需要控制温度在80℃~90℃之间的原因是 , 采用水浴加热,经蒸发浓缩、(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。 (5)、写出检验“沉锰”是否已完成的实验操作。(6)、常温下,马日夫盐溶液显性(填“酸”或“碱”),理由是:。(写出计算过程并结合必要的文字说明。已知: 的电离常数 , , )
(5)、写出检验“沉锰”是否已完成的实验操作。(6)、常温下,马日夫盐溶液显性(填“酸”或“碱”),理由是:。(写出计算过程并结合必要的文字说明。已知: 的电离常数 , , )四、综合题
-
10. 消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)、Ⅰ.化学上采用 处理 不仅可以消除污染,还可作为工业生产的能量来源。
工业上可采用 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。

①该反应历程中正反应的最大活化能为 。
②合成氨反应的热化学方程式为。
(2)、不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中 的物质的量分数如图2所示。①M点的 N点的 (填“>”、“<”或“=”)。

② ℃时,将 和 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K= (用最简分数表示)。
(3)、Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。①用次氯酸钠除去氨氮(以 示)的原理如图3所示。写出总反应的化学方程式:。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随 的变化情况如图4所示。当 时,水体中总氮去除率反而下降,可能的原因是。
(4)、近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将 转化为 ,部分装置如图5所示。
①B电极的电极反应式是.
②常温下,除去10L废水中的 后,最终废水的 (电解前后废水的体积变化忽略不计)。
11. 药物瑞德西韦(Remdesivir)对新型冠状病毒(2019-nCoV)有一定的抑制作用;I为该药物合成的中间体,其合成路线如下: (1)、I的结构如图:
(1)、I的结构如图: 已知:
已知: ①
②

回答下列问题:
B的化学名称为。
(2)、由B生成C的化学方程式为。(3)、D可由 经水解、酸化而得。水解的条件是。 (4)、E的含氧官能团除硝基外还有(填化学名称),由E生成F的反应类型是 , 另一种有机产物的结构简式为。(5)、G中含有两个Cl原子,则G的结构简式为。(6)、X是E的同分异构体,写出满足下列条件的X的结构简式。
经水解、酸化而得。水解的条件是。 (4)、E的含氧官能团除硝基外还有(填化学名称),由E生成F的反应类型是 , 另一种有机产物的结构简式为。(5)、G中含有两个Cl原子,则G的结构简式为。(6)、X是E的同分异构体,写出满足下列条件的X的结构简式。①苯环上含有硝基且苯环上只有一种氢原子;
②遇 溶液发生显色反应;
③1mol的X与足量金属Na反应可生成2g 。
(7)、设计由苯甲醇制备化合物 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。 五、填空题
-
12. 过氧乙酸又名过醋酸 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为 。(1)、某同学写出了碳原子的4种不同状态的电子排布图:
a.
 b.
b. 
c.
 d.
d. 
其中能量最低的是(填标号),电子由状态C到状态B所得到的光谱为光谱(填“原子发射”或“原子吸收”)。
(2)、过氧乙酸分子中C原子的杂化方式有。(3)、乙酸比乙醇易电离出 的原因。(4)、熔点:乙酸硝酸(填“>”、“<”或“=”),理由。(5)、造纸中,用 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。①两种硼氢化物的熔点如下表所示:
硼氢化物
熔点/℃
400
-64.5
解释表中两种物质熔点差异的原因。
②硼氢化钠晶胞结构如图所示,该晶体中 的配位数为。已知:硼氢化钠晶体的密度为 , 代表阿伏加德罗常数的值,则a=nm(用含 、 的最简式子表示)。

-
-