江苏省苏州市2020年中考化学试卷
试卷更新日期:2020-07-22 类型:中考真卷
一、单选题
-
1. “垃圾分类工作就是新时尚”。废旧报纸应投入的垃圾箱是( )A、
 B、
B、 C、
C、 D、
D、 2. 下列物质属于氧化物的是( )A、O3 B、SO3 C、NaOH D、K2SO43. 下列变化属于化学变化的是( )A、干冰升华 B、衣服晾干 C、冰雪融化 D、食物腐败4. 下列物质由离子构成的是( )A、铜 B、水 C、氯化钠 D、氖气5. 四氯化钛(TiCl4)可用于冶炼金属钛。四氯化钛中钛元素的化合价为( )A、+4 B、-4 C、0 D、-16. 下列实验操作图示正确的是( )A、加热液体
2. 下列物质属于氧化物的是( )A、O3 B、SO3 C、NaOH D、K2SO43. 下列变化属于化学变化的是( )A、干冰升华 B、衣服晾干 C、冰雪融化 D、食物腐败4. 下列物质由离子构成的是( )A、铜 B、水 C、氯化钠 D、氖气5. 四氯化钛(TiCl4)可用于冶炼金属钛。四氯化钛中钛元素的化合价为( )A、+4 B、-4 C、0 D、-16. 下列实验操作图示正确的是( )A、加热液体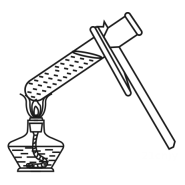 B、测定pH
B、测定pH 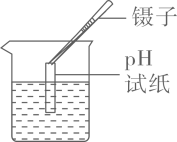 C、滴加液体
C、滴加液体 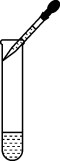 D、检查气密性
D、检查气密性 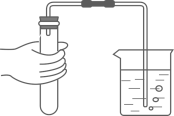 7. 下列常见材料中,属于合成材料的是( )A、陶瓷 B、焊锡 C、塑料 D、钢筋混凝土8. 下列有关化学用语表示正确的是( )A、五氧化二磷:P2O5 B、银元素:AG C、2个镁离子:2Mg+2 D、8个硫原子:S89. 工业用反应 来制备纯碱,该反应属于( )A、分解反应 B、化合反应 C、置换反应 D、复分解反应10. 下列有关氧气的说法中,错误的是( )A、氧气可供给呼吸 B、鱼类能在水中生存,说明氧气易溶于水 C、植物的光合作用是空气中氧气的主要来源 D、焊接或切割金属时使用纯氧代替空气以获得更高的温度11. 某净水装置如图所示。下列说法正确的是( )
7. 下列常见材料中,属于合成材料的是( )A、陶瓷 B、焊锡 C、塑料 D、钢筋混凝土8. 下列有关化学用语表示正确的是( )A、五氧化二磷:P2O5 B、银元素:AG C、2个镁离子:2Mg+2 D、8个硫原子:S89. 工业用反应 来制备纯碱,该反应属于( )A、分解反应 B、化合反应 C、置换反应 D、复分解反应10. 下列有关氧气的说法中,错误的是( )A、氧气可供给呼吸 B、鱼类能在水中生存,说明氧气易溶于水 C、植物的光合作用是空气中氧气的主要来源 D、焊接或切割金属时使用纯氧代替空气以获得更高的温度11. 某净水装置如图所示。下列说法正确的是( )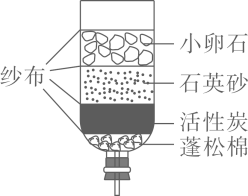 A、该装置能对水进行杀菌消毒 B、该装置能除去水中的颜色和异味 C、硬水经过该装置后可转化为软水 D、自来水经过该装置后可得蒸馏水12. 下列指定反应的化学方程式正确的是( )A、镁条燃烧: B、铜绿分解: C、氨水中和硫酸: D、酒精完全燃烧:13. 利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A、该装置能对水进行杀菌消毒 B、该装置能除去水中的颜色和异味 C、硬水经过该装置后可转化为软水 D、自来水经过该装置后可得蒸馏水12. 下列指定反应的化学方程式正确的是( )A、镁条燃烧: B、铜绿分解: C、氨水中和硫酸: D、酒精完全燃烧:13. 利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )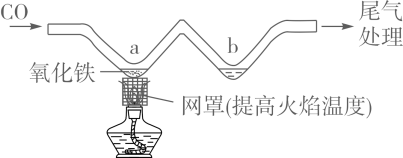 A、实验时应先点燃酒精灯后通CO B、充分加热,a处固体由黑色变为红色 C、b处可用澄清石灰水检验生成的CO2 D、可用NaOH溶液吸收尾气中的CO14. 下列物质的性质与用途具有对应关系的是( )A、天然气难溶于水,可用作燃料 B、碳酸氢铵受热易分解,可用作化肥 C、石墨有导电性,可用于生产铅笔芯 D、小苏打能与盐酸反应,可用于治疗胃酸过多15. 下列关于溶液的说法正确的是( )A、溶液一定是无色透明的液体 B、饱和溶液降温后都有溶质结晶析出 C、碘酒溶液中,碘是溶质,酒精是溶剂 D、水加入蔗糖后形成溶液,导电性明显增强16. 下列各组离子在溶液中能大量共存的是( )A、NH 、SO 、NO B、H+、Ba2+、OH- C、Fe2+、Na+、OH- D、Ca2+、Cl-、CO17. K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是( )
A、实验时应先点燃酒精灯后通CO B、充分加热,a处固体由黑色变为红色 C、b处可用澄清石灰水检验生成的CO2 D、可用NaOH溶液吸收尾气中的CO14. 下列物质的性质与用途具有对应关系的是( )A、天然气难溶于水,可用作燃料 B、碳酸氢铵受热易分解,可用作化肥 C、石墨有导电性,可用于生产铅笔芯 D、小苏打能与盐酸反应,可用于治疗胃酸过多15. 下列关于溶液的说法正确的是( )A、溶液一定是无色透明的液体 B、饱和溶液降温后都有溶质结晶析出 C、碘酒溶液中,碘是溶质,酒精是溶剂 D、水加入蔗糖后形成溶液,导电性明显增强16. 下列各组离子在溶液中能大量共存的是( )A、NH 、SO 、NO B、H+、Ba2+、OH- C、Fe2+、Na+、OH- D、Ca2+、Cl-、CO17. K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是( )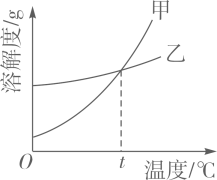
温度/℃
20
40
50
60
80
溶解度/g
K2CO3
110
117
121
126
139
KNO3
31.6
63.9
85.5
110
169
A、K2CO3的溶解度大于KNO3 B、乙代表K2CO3的溶解度曲线 C、t应在50℃~60℃之间 D、40℃时,100gKNO3饱和溶液中含63.9gKNO318. 下列实验方案不能达到目的的是( )A、鉴别:用熟石灰鉴别NH4Cl固体和NH4NO3固体 B、除杂:用浓硫酸除去O2中混有的少量水蒸气 C、检验:用高锰酸钾溶液检验CO2中是否混有SO2 D、制备:实验室用锌粒和稀硫酸制备少量H219. 在给定条件下,下列选项所示的物质间转化不能实现的是( )A、 B、 C、 D、20. 用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是( ) A、甲中逸出的气体只含CO2 B、乙中液体变红,证明CO2能与水反应 C、加热后红色不褪去,说明碳酸受热不分解 D、欲达到实验目的,可将盐酸改为稀硫酸
A、甲中逸出的气体只含CO2 B、乙中液体变红,证明CO2能与水反应 C、加热后红色不褪去,说明碳酸受热不分解 D、欲达到实验目的,可将盐酸改为稀硫酸二、填空题
-
21. 化学与人类生活息息相关。请回答下列问题。(1)、化石燃料燃烧产生大量CO2 , 加剧了大气层的效应。(2)、油锅起火可盖上锅盖使火熄灭,其灭火原理是。(3)、大米中含有的糖类物质主要是(填名称)。(4)、儿童患佝偻病、骨骼疏松是因为缺少元素。(5)、用铁制作炊具是利用其良好的延展性和性。22. 铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。(1)、人类冶炼和使用金属铝的时间较晚。可能是因为(填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)、用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:。(3)、用砂纸去除铝片表面的氧化膜,将其浸人硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验气体为氢气。①写出生成红色物质的化学方程式:。
②硫酸铜溶液中的阳离子有(填离子符号)。
(4)、原子簇是若干个原子的聚集体,有望开发成新材料。某铝原子簇由13个铝原子构成,其最外层电子数的总和为40时相对稳定。写出该稳定铝原子簇的微粒符号:。(铝原子的结构示意图为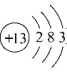 ) 23. 氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点(1)、Ⅰ.氢气的制取
) 23. 氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点(1)、Ⅰ.氢气的制取科学家正致力于研究在催化剂和光照条件下分解水制氢气。写出该反应的化学方程式: , 该反应(填“放出”或“吸收”)能量。
(2)、水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图所示。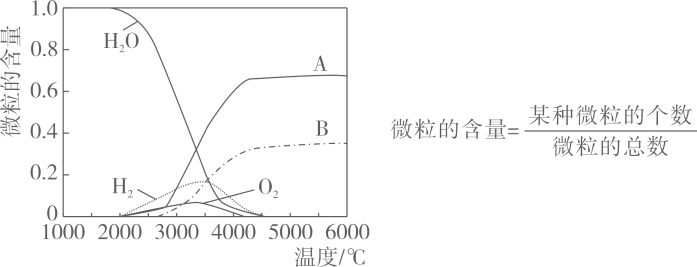
图中曲线A、B对应的微粒依次是(填符号)。
(3)、Ⅱ.氢气的储存一种镁铜合金可用于储氢。
①将镁、铜单质按比例在一定温度下熔炼得到上述合金。熔炼时须通入氩气,其目的是。
②350℃时,该镁铜合金与氢气反应,生成了一种仅含Mg、H两种元素的化合物,其中氢元素的质量分数为7.7%。该化合物的化学式为。
三、实验题
-
24. 某兴趣小组制取氧气,并尝试回收部分药品。可能用到的部分装置如图。
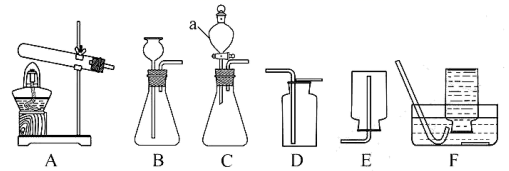 (1)、上图中仪器a的名称是。(2)、用双氧水和MnO2制氧气。发生反应的化学方程式为 , 收集氧气的装置可选用(填字母)。(3)、加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为: )
(1)、上图中仪器a的名称是。(2)、用双氧水和MnO2制氧气。发生反应的化学方程式为 , 收集氧气的装置可选用(填字母)。(3)、加热KClO3固体制氧气(1.5gMnO2作催化剂),并对KClO3完全分解后的残留固体进行分离。(已知反应原理为: )①发生装置应选用(填字母)。
②KCl的溶解度曲线如图所示。将残留固体冷却至室温(20℃),称得其质量为4.8g。欲将KCl全部溶解,至少应加入该温度下蒸馏水的体积约(填字母)。
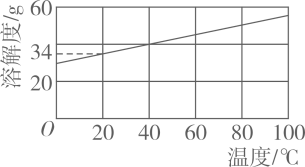
a.5mL
b.10mL
c.20mL
d.30mL
③对溶解所得混合物进行过滤,滤渣经处理得MnO2。从滤液中获得KCl晶体的最佳方法是。
25. 碳酸钠俗称纯碱或苏打,在生活、生产和实验硏究中均有广泛应用。(配制溶液)配制溶质质量分数分別为1%、2%和4%的Na2CO3溶液
(1)、若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是(填字母)。a.用托盘天平称取2gNa2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)、分别测定25℃时,上述3种溶液的pH,记录数据如下:实验编号
Ⅰ
Ⅱ
Ⅲ
溶质质量分数
1%
2%
4%
溶液pH
11.62
11.76
11.90
分析I、Ⅱ、Ⅲ三组数据可得出的结论是。
(3)、在烧杯中制备FeCO3沉淀时,应选用的加料方式是(填字母)。a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)、潮湿的FeCO3固体置于空气中易变质,反应如下: ,则X的化学式为。(5)、(标定浓度)标定待测盐酸的溶质质量分数将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于1g·mL-1 , 反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将(填“偏大”、“偏小”或“无影响”)。
26. 钢铁的腐蚀是重要研究课题。(知识回顾)用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
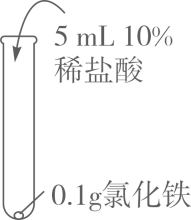
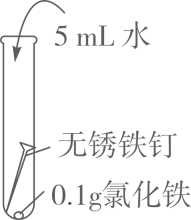
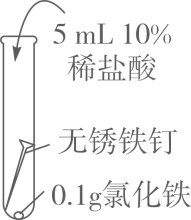
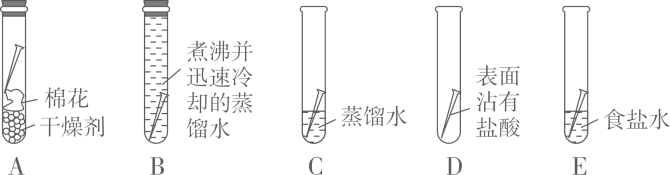 (1)、由A、B、C的现象可知,铁的锈蚀是铁跟(填化学式)等物质作用的过程。(2)、试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是。(3)、(实验探究)向试管D中(含生锈铁钉)加入过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(1)、由A、B、C的现象可知,铁的锈蚀是铁跟(填化学式)等物质作用的过程。(2)、试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是。(3)、(实验探究)向试管D中(含生锈铁钉)加入过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。写出铁锈溶于盐酸的化学方程式:。
(4)、推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如下3个实验(持续10小时,已知氢气不影响该反应)。序号
实验I
实验Ⅱ
实验Ⅲ
实验内容
现象
溶液颜色始终呈黄色
产生红褐色沉淀
溶液逐渐由黄色变浅绿色
①设计实验I的目的是。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是。
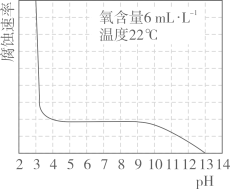
(5)、(拓展延仲)研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。如图表示水样温度22℃、氧含量6mL·L-1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是。
 (6)、如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是。
(6)、如图表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL·L-1时,钢铁腐蚀速率明显下降的原因可能是。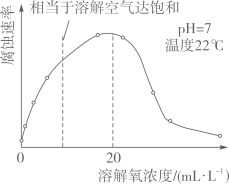
四、科普阅读题
-
27. 阅读下面的科普短文,回答相关问题
氨是一种重要的化学物质,可用于制造硝酸和氮肥。氨主要来自于人工合成。1909年,弗里茨·哈伯成功地利用氮气和氢气合成出氨。工业合成氨的流程如图(左)所示。为了找到合成氨反应合适的催化剂,人们做了6500多次实验,发现铁触媒效果较好。在铁触媒作用下,用体积比为1:3的氮气和氢气合成氨,当容器中氨的含量不再发生变化时(平衡时),测得氨的含量分别与温度和压强的关系如图(右)所示。1913年第一座合成氨工厂建立。如今全球合成氨年产量超千万吨,其中大约85%的氨用于生产氮肥,缓解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
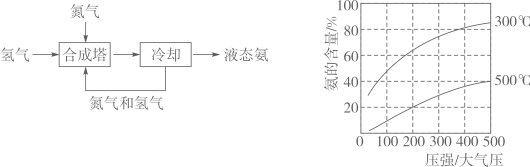 (1)、工业上可用的方法获得合成氨的原料N2。(2)、甲烷和H2O高温下反应得到CO和原料气H2 , 该反应的化学方程式为。(3)、从“合成塔”中出来的气体是(填“纯净物”或“混合物”)。(4)、科学家研究合成氨反应催化剂的目的是。(5)、按下列条件进行合成氨反应,平衡时氨的含量最高的是(填字母)。
(1)、工业上可用的方法获得合成氨的原料N2。(2)、甲烷和H2O高温下反应得到CO和原料气H2 , 该反应的化学方程式为。(3)、从“合成塔”中出来的气体是(填“纯净物”或“混合物”)。(4)、科学家研究合成氨反应催化剂的目的是。(5)、按下列条件进行合成氨反应,平衡时氨的含量最高的是(填字母)。a、200大气压、300℃
b、200大气压、500℃
c、400大气压、300℃
d、400大气压、500℃
五、流程题
-
28. 硝酸钙可用于无土栽培等。一种利用石灰石制备硝酸钙晶体的流程如下:
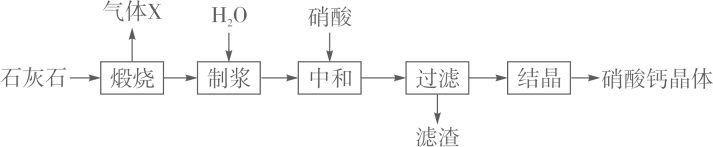
已知:硝酸会挥发、受热会分解。
(1)、气体X为(填化学式)。(2)、“制浆”所得的混合物属于_______(填字母)。A、溶液 B、悬浊液 C、乳浊液(3)、写出“中和”步骤主要反应的化学方程式:。(4)、工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和。(5)、“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入水量太多会导致_。(6)、若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低、同时会产生污染气体NOx。产生NOx的原因是。
-