山东省枣庄市2020年中考化学模拟试卷
试卷更新日期:2020-07-22 类型:中考模拟
一、单选题
-
1. 人类的进步离不开化学的贡献。下列有关化学史的说法错误的是( )A、拉瓦锡用红磷燃烧的实验证明了氧气约占空气总质量的五分之一 B、阿伏加德罗等科学家研究得出结论:分子中原子的重新组合是化学变化的基础 C、我国化学家侯德榜发明了“侯氏制碱法” D、英国科学家波义耳最早发现使用“石蕊”酸碱指示剂2. 在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表所示。下列说法错误的是( )
甲
乙
丙
丁
反应前的质量(g)
15
12
14
20
反应后的质量(g)
11
0
x
y
A、参加反应的甲和乙的质量之比为1:3 B、x的取值范围是:0≤x≤30 C、当y≤20时,该反应为化合反应 D、x+y=503. 锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用。结合图中信息,下列叙述正确的是( ) A、锰原子核内有25个质子,一个锰原子的质量是54.94g B、锰原子核外有4个电子层,其化学性质由最内层电子数决定 C、MnO2属于氧化物,能做所有化学反应的催化剂 D、KMnO4为紫黑色固体,易溶于水形成紫红色溶液4. 下列实验设计或结论合理的是( )A、向某固体滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 B、除去MgCl2溶液中混有的少量CuCl2 , 可加入适量的Mg(OH)2 , 充分搅拌后过滤 C、CO32﹣、Na+、NO3﹣、K+四种离子可在pH=12的溶液中大量共存 D、将带火星的木条伸入到装有气体的集气瓶中,木条不复燃,证明该气体中不含氧气5. 下列实验不能达到实验目的的是( )A、
A、锰原子核内有25个质子,一个锰原子的质量是54.94g B、锰原子核外有4个电子层,其化学性质由最内层电子数决定 C、MnO2属于氧化物,能做所有化学反应的催化剂 D、KMnO4为紫黑色固体,易溶于水形成紫红色溶液4. 下列实验设计或结论合理的是( )A、向某固体滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 B、除去MgCl2溶液中混有的少量CuCl2 , 可加入适量的Mg(OH)2 , 充分搅拌后过滤 C、CO32﹣、Na+、NO3﹣、K+四种离子可在pH=12的溶液中大量共存 D、将带火星的木条伸入到装有气体的集气瓶中,木条不复燃,证明该气体中不含氧气5. 下列实验不能达到实验目的的是( )A、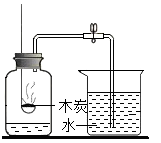 测定空气中氧气含量
B、
测定空气中氧气含量
B、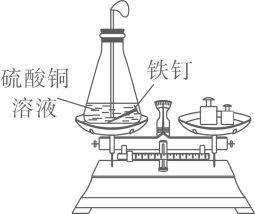 验证质量守恒定律
C、
验证质量守恒定律
C、 探究可燃物燃烧条件
D、
探究可燃物燃烧条件
D、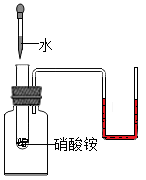 验证硝酸铵溶解吸热
6. 下列所描述的现象或变化中属于物理变化的是( )A、用氢氧化钠干燥O2、N2等 B、石蕊试液遇酸性溶液变为红色 C、石灰浆抹墙后,墙壁变硬 D、用生石灰制熟石灰7. 一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下图所示。
验证硝酸铵溶解吸热
6. 下列所描述的现象或变化中属于物理变化的是( )A、用氢氧化钠干燥O2、N2等 B、石蕊试液遇酸性溶液变为红色 C、石灰浆抹墙后,墙壁变硬 D、用生石灰制熟石灰7. 一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如下图所示。
下列关于以上反应的说法中,正确的是( )
A、X的值为44 B、W由碳、氢两种元素组成 C、该反应属于置换反应 D、W中碳、氢元素质量比为4∶18. 下列试剂分别滴入Ca(OH)2、H2SO4、Na2SO4三种溶液中,会出现三种不同现象的是( )A、Na2CO3溶液 B、MgCl2溶液 C、Ba(OH)2溶液 D、酚酞溶液二、填空题
-
9. 以化合价为纵坐标,以物质的类别为横坐标所绘制的图像叫价类图。如图为铁的价类图,例如E点可表示+2价的亚铁盐。请回答:
 (1)、A点表示的物质所属的物质类别是。(2)、请写出B点表示的物质化学式。(3)、已知C点表示的化合物在常温下能与氧气、水发生化合反应生成D,写出相应的化学方程式。10.(1)、酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的 , 实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题:
(1)、A点表示的物质所属的物质类别是。(2)、请写出B点表示的物质化学式。(3)、已知C点表示的化合物在常温下能与氧气、水发生化合反应生成D,写出相应的化学方程式。10.(1)、酸、碱、盐在生活、生产中应用广泛,使用时必须十分小心,氢氧化钠具有强烈的 , 实验时最好戴防护眼镜,为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请你根据要求完成下列问题: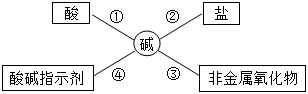
小丽同学发现,以前取用氢氧化钠溶液时试剂瓶忘记盖瓶塞,依据反应③说明NaOH必须密封保存,否则在空气中要变质,如果该溶液变质,则发生反应的化学方程式为;
(2)、要检验该氢氧化钠溶液已变质,选择下列试剂不能达到目的是________A、稀HCl B、酚酞试液 C、CaCl2 D、Ca(OH)2(3)、为了验证反应④,小丽将无色酚酞试液分别滴入NaOH溶液和澄清石灰水中,溶液由无色变成红色,原因是它们在水溶液中能电离出。(4)、依据反应②,KOH能与下列物质反应的是A.H2SO4
B.BaCl2
C.CuSO4
D.Na2CO3
发生反应的化学方程式为:
(5)、硫酸铵[(NH4)2SO4]、磷酸二氢钙[Ca(H2PO4)2]、亚硝酸钠(NaNO2)、硝酸钾(KNO3)等属于盐,其中又属于复合肥的是。11. 甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息,回答下列问题: (1)、50℃时,乙物质的溶解度是g。(2)、20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为。(3)、温度为℃时,甲、乙两物质溶解度相同。(4)、50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是。(5)、要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是。12. 额温枪在疫情防控中发挥着无可替代的重要作用,下图是额温枪及所用电池示意图,回答下列问题:
(1)、50℃时,乙物质的溶解度是g。(2)、20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为。(3)、温度为℃时,甲、乙两物质溶解度相同。(4)、50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是。(5)、要配制110g溶质质量分数为9.1%的丙物质溶液,配制时溶液的温度需要控制的范围是。12. 额温枪在疫情防控中发挥着无可替代的重要作用,下图是额温枪及所用电池示意图,回答下列问题: (1)、所标物质中,含有的有机合成材料是 , 含有的金属材料是。(2)、电池内部有一根碳棒,主要利用其性。(3)、写出能直接表示锌和铜活泼性强弱的化学方程式:。
(1)、所标物质中,含有的有机合成材料是 , 含有的金属材料是。(2)、电池内部有一根碳棒,主要利用其性。(3)、写出能直接表示锌和铜活泼性强弱的化学方程式:。三、综合题
-
13. 根据粗盐中难溶性杂质的去除和溶液的配制实验图示回答相关问题:
 (1)、操作④中玻璃棒的作用是。(2)、若按照②③①步骤配制50g16%的NaCl溶液,所配制溶液的溶质质量分数(填“偏大”、“偏小”或“无影响”)。(3)、操作⑤中停止加热的时间是。(4)、除去粗盐中难溶性的杂质并计算精盐的产率,其正确操作步骤为(填序 号)。(5)、以下操作中可能会导致精盐产率(产率=精盐质量/粗盐质量×100%)偏小的有(填序号)。
(1)、操作④中玻璃棒的作用是。(2)、若按照②③①步骤配制50g16%的NaCl溶液,所配制溶液的溶质质量分数(填“偏大”、“偏小”或“无影响”)。(3)、操作⑤中停止加热的时间是。(4)、除去粗盐中难溶性的杂质并计算精盐的产率,其正确操作步骤为(填序 号)。(5)、以下操作中可能会导致精盐产率(产率=精盐质量/粗盐质量×100%)偏小的有(填序号)。A.操作①中有少量溶液溅出烧杯
B.操作③中仰视读数
C.操作④中液面高于滤纸边缘
D.操作⑤中没有使用玻璃棒搅拌
(6)、如果粗盐中含 SO42-量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是____________。A、Ba(OH)2 B、Ba(NO3)2 C、BaCl2 D、BaSO4(7)、为了有效地除去Ca2+、Mg2+、SO42- ,加入试剂的合理顺序为_________________。A、先加入NaOH,后加入Na2CO3 , 再加入钡试剂 B、先加入NaOH,后加入钡试剂,再加入Na2CO3 C、先加入钡试剂,后加入NaOH,再加入Na2CO3 D、先加入Na2CO3 , 后加入钡试剂,再加NaOH(8)、脱盐工序中,通过加热、浓缩、冷却、过滤的方法除去NaCl,该方法利用的是NaOH与NaCl这两物质在上的性质差异。(9)、检验脱盐是否完全的实验方法是。四、计算题
-
14. 取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的NaOH溶液,产生沉淀质量与滴入NaOH溶液质量的关系如图所示.
 (1)、滴入NaOH溶液的质量在0~4g时,发生反应的化学方程式为 ;(2)、与氯化铜反应的NaOH的质量为 g;(3)、原盐酸与氯化铜的混合溶液中氯化铜的质量分数(写出计算过程).
(1)、滴入NaOH溶液的质量在0~4g时,发生反应的化学方程式为 ;(2)、与氯化铜反应的NaOH的质量为 g;(3)、原盐酸与氯化铜的混合溶液中氯化铜的质量分数(写出计算过程).
-