天津市红桥区2020年高考化学一模试卷
试卷更新日期:2020-07-15 类型:高考模拟
一、单选题
-
1. 下列“中国制造”所用材料属于有机高分子材料的是( )A、北京大兴国际机场航站楼所用水泥 B、北斗卫星太阳能电池板所用高纯硅 C、国产航母“山东舰”舰身所用无磁镍铬钛合金钢 D、医用口罩中间过滤层所用高熔融指数聚丙烯(PP)材料2. 下列化学用语表示正确的是( )A、中子数为20的硫原子: B、N2的共价键类型:π键和σ键 C、Na2S的电子式:Na

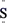
 Na
D、S2-水解的离子方程式:S2-+2H2O = H2S +2OH-
3. 下列各组性质比较中,正确的是( )A、第一电离能:K > Na > Li B、沸点:HF > HCl > HBr > HI C、离子还原性:S2-> Cl-> Br-> I- D、离子半径:O2- > F-> Na+> Mg2+4. 新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140 nm,怕酒精,不耐高温。下列说法正确的是( )A、该病毒由碳、氢、氧三种元素组成 B、该病毒扩散到空气中可形成气溶胶 C、该病毒怕酒精是因为酒精具有强氧化性 D、该病毒因在高温下发生盐析而不耐高温5. 全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法错误的是( )
Na
D、S2-水解的离子方程式:S2-+2H2O = H2S +2OH-
3. 下列各组性质比较中,正确的是( )A、第一电离能:K > Na > Li B、沸点:HF > HCl > HBr > HI C、离子还原性:S2-> Cl-> Br-> I- D、离子半径:O2- > F-> Na+> Mg2+4. 新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140 nm,怕酒精,不耐高温。下列说法正确的是( )A、该病毒由碳、氢、氧三种元素组成 B、该病毒扩散到空气中可形成气溶胶 C、该病毒怕酒精是因为酒精具有强氧化性 D、该病毒因在高温下发生盐析而不耐高温5. 全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法错误的是( ) A、钢铁腐蚀时化学能不能全部转化为电能 B、钢铁腐蚀的负极反应式为Fe-2e-=Fe2+ C、如图所示,将导线与金属锌相连可保护地下铁管 D、如图所示,将导线与外接电源的正极相连可保护地下铁管6. 下列解释事实的离子方程式书写正确的是( )A、FeCl3溶液腐蚀线路板:Fe3+ + Cu = Fe2+ + Cu2+ B、Na2CO3溶液处理水垢中的CaSO4:Ca2+ + CO32-= CaCO3↓ C、84消毒液与洁厕灵混用产生有毒气体:ClO-+ 2H+ + Cl- = Cl2↑ + H2O D、稀HNO3洗涤做过银镜反应的试管:Ag + 2H+ + NO3-= Ag+ + NO2↑ + H2O7. 下列说法中正确的是( )A、共价化合物中一定不含离子键 B、非极性分子中一定不含极性键 C、元素的金属性越强,第一电离能一定越小 D、分子间作用力越大,分子的热稳定性一定越强8. 下列实验操作会使实验最终结果偏高的是( )A、用湿润的pH 试纸测定NaOH的pH B、配制100 mL 1.00 mol·L -1 NaCl溶液,定容时俯视刻度线 C、用0.0001 mol·L -1盐酸滴定20.00 mL NaOH溶液,起始读数时仰视 D、测定中和热的数值时,将0.5 mol·L -1NaOH溶液倒入盐酸后,立即读数9. 线型 PAA(
A、钢铁腐蚀时化学能不能全部转化为电能 B、钢铁腐蚀的负极反应式为Fe-2e-=Fe2+ C、如图所示,将导线与金属锌相连可保护地下铁管 D、如图所示,将导线与外接电源的正极相连可保护地下铁管6. 下列解释事实的离子方程式书写正确的是( )A、FeCl3溶液腐蚀线路板:Fe3+ + Cu = Fe2+ + Cu2+ B、Na2CO3溶液处理水垢中的CaSO4:Ca2+ + CO32-= CaCO3↓ C、84消毒液与洁厕灵混用产生有毒气体:ClO-+ 2H+ + Cl- = Cl2↑ + H2O D、稀HNO3洗涤做过银镜反应的试管:Ag + 2H+ + NO3-= Ag+ + NO2↑ + H2O7. 下列说法中正确的是( )A、共价化合物中一定不含离子键 B、非极性分子中一定不含极性键 C、元素的金属性越强,第一电离能一定越小 D、分子间作用力越大,分子的热稳定性一定越强8. 下列实验操作会使实验最终结果偏高的是( )A、用湿润的pH 试纸测定NaOH的pH B、配制100 mL 1.00 mol·L -1 NaCl溶液,定容时俯视刻度线 C、用0.0001 mol·L -1盐酸滴定20.00 mL NaOH溶液,起始读数时仰视 D、测定中和热的数值时,将0.5 mol·L -1NaOH溶液倒入盐酸后,立即读数9. 线型 PAA( )具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是( )
)具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是( )  A、线型 PAA 的单体不存在顺反异构现象 B、形成网状结构的过程发生了加聚反应 C、交联剂 a 的结构简式是
A、线型 PAA 的单体不存在顺反异构现象 B、形成网状结构的过程发生了加聚反应 C、交联剂 a 的结构简式是 D、PAA 的高吸水性与—COONa 有关
10. 如图已知反应S2O82- (aq) + 2I-(aq) 2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( )
D、PAA 的高吸水性与—COONa 有关
10. 如图已知反应S2O82- (aq) + 2I-(aq) 2SO42-(aq) + I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下:下列有关该反应的说法错误的是( )
①2Fe3+ (aq) + 2I- (aq) I2 (aq) + 2Fe2+ (aq)
②2Fe2+ (aq) + S2O82- (aq) 2Fe3+ (aq) + 2SO42- (aq)
A、Fe3+是该反应的催化剂 B、S2O82- (aq) + 2I-(aq) 2SO42-(aq) + I2(aq)是放热反应 C、加入Fe3+ 后降低了该反应的活化能 D、向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深11. 铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体在不同温度下转化的图示。下列有关说法中正确的是( )
δ-Fe γ-Fe α-Fe
A、δ、γ、α三种晶体互为同分异构体 B、γ-Fe晶体为面心立方体紧密堆积 C、α-Fe晶体与每个Fe原子距离相等且最近的Fe原子有8个 D、将Fe加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同12. 室温下将0.1mol·L-1的烧碱溶液不断滴加到10.00mL相同浓度的HA溶液中,溶液中-lgc水(H+)与NaOH溶液的体积关系如图所示[注:c水(H+)为溶液中水电离的c(H+)]。下列说法错误的是( ) A、a、c两点溶液中均存在:c(H+)+c(Na+)=c(OH-)+c(A-) B、b点溶液中存在:c(H+)+c(HA)=c(OH-) C、a、b、c三点溶液中,b点溶液导电性最强 D、0.1mol·L-1HA溶液中HA的电离度约为1%
A、a、c两点溶液中均存在:c(H+)+c(Na+)=c(OH-)+c(A-) B、b点溶液中存在:c(H+)+c(HA)=c(OH-) C、a、b、c三点溶液中,b点溶液导电性最强 D、0.1mol·L-1HA溶液中HA的电离度约为1%二、综合题
-
13. 砷化镓(GaAs)灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓(GaAs)、 氮化镓(GaN)等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:(1)、基态N原子核外电子排布图为 ;Ga与Al同主族,且位于Al的下一周期,则基态Ga原子的价电子排布式为 。(2)、Ga的电负性比As(填“大”或“小”);Ga逐级失去电子的电离能 (单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知Ga的主要化合价为和+3。(3)、比较下列Ga的卤化物的熔点和沸点, GaCl3、GaBr3、GaI3的熔、沸点依次升高, 分析其变化的原因是:。
镓的卤化物
GaCl3
GaBr3
GaI3
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
GaF3的熔点超过1000℃,可能的原因是。
(4)、GaAs是将(CH3)3Ga和AsH3用金属有机物化学气相淀积方法制备得到,该反应在700℃下进行①则该反应的化学方程式为:。
②反应物AsH3分子的几何构型为 , (CH3)3Ga中镓原子杂化方式为。
14. 碳、氮是重要的非金属元素,在生产、生活中有广泛的应用。(1)、已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l) C6H12O6(s)+6O2(g) △H=+669.62 kJ•mol-1该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是。a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
(2)、N2O5的分解反应2N2O5(g) 4NO2(g) + O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:时间/min
0
1
2
3
4
5
c(N2O5) /(mol•L﹣1)
1.00
0.71
0.50
0.35
0.25
0.17
计算在0~2min时段,化学反应速率v(NO2) =mol•L-1•min-1。
(3)、若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为(填化学式);A电极的电极反应式为 , 一段时间后,若乙中需加0.2 mol Cu(OH)2使溶液复原,则转移的电子的物质的量为 。 (4)、若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1 , 反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
(4)、若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1 , 反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如下图
①b点时,平衡体系中C、N原子个数之比接近;
②a、b、c三点CO的转化率从大到小的顺序为;a、c、d三点的平衡常数从大到小的顺序为。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为。
三、推断题
-
15. 某有机物K是治疗急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病药物的中间体,其合成路线如下,回答下列问题:

已知信息:
①

②

③R1CHO+R2NH2 →R1CH=N−R2
(1)、B→C的反应类型为 , H中官能团的名称为。(2)、G的结构简式为 , F→G的反应类型为。(3)、D→E的反应方程式为。(4)、写出化合物D同时符合下列条件的同分异构体的结构简式。①苯环上有两个取代基,官能团与D相同,苯环上的一氯代物有两种
②核磁共振氢谱显示峰面积比为2:2:2:3
(5)、已知:通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。写出以 和
和  为原料制备
为原料制备  的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。 四、实验题
-
16. 某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:
 (1)、C中发生反应的化学方程式是 , B装置的名称是 , 关于该套装置说法正确的是(填标号)。
(1)、C中发生反应的化学方程式是 , B装置的名称是 , 关于该套装置说法正确的是(填标号)。a 组装仪器、加入药品后检查气密性 b 实验开始和最后时均需要通入空气
c 利用A、B装置是为了减小实验误差 d F、G中的碱石灰可以换为无水CaCl2
(2)、甲同学认为很快可以看到D装置的现象,他的依据是(用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:第一步: (快反应)
第二步: (慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴试剂,相应的实验现象是。
(3)、学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为L。该实验的设计中,仍然存在系统误差的可能原因是。
-