天津市和平区2020年高考化学二模试卷
试卷更新日期:2020-07-15 类型:高考模拟
一、单选题
-
1. 手工制作工艺在我国有着悠久的历史,是中华民族文化艺术的瑰宝。下列手工艺品用金属材料制成的是( )A、北京唐人
 B、山东面塑
B、山东面塑  C、芜湖铁画
C、芜湖铁画  D、东阳木雕
D、东阳木雕  2. 党的十九大报告中多次提及“绿色”、“生态文明”。下列做法不应该提倡的是( )A、分类放置生活废弃物 B、实现化石燃料清洁利用 C、使用聚碳酸酯类可降解塑料 D、大量使用化肥、农药提高粮食产量3. 下列物质放入水中发生化学反应,水做氧化剂的是( )A、钠 B、氯气 C、氧化钙 D、过氧化钠4. 下列化学用语对事实的表述错误的是( )A、氯原子的结构示意图:
2. 党的十九大报告中多次提及“绿色”、“生态文明”。下列做法不应该提倡的是( )A、分类放置生活废弃物 B、实现化石燃料清洁利用 C、使用聚碳酸酯类可降解塑料 D、大量使用化肥、农药提高粮食产量3. 下列物质放入水中发生化学反应,水做氧化剂的是( )A、钠 B、氯气 C、氧化钙 D、过氧化钠4. 下列化学用语对事实的表述错误的是( )A、氯原子的结构示意图: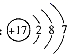 B、羰基硫(COS)的结构式为
C、
B、羰基硫(COS)的结构式为
C、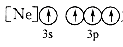 为Si原子的一种激发态
D、中子数为10的氧原子形成的过氧根离子:
5. 下列有关说法错误的是( )A、向Mg(OH)2加入足量稀硫酸,加热浓缩,冷却结晶后得到硫酸镁晶体 B、氨水清除试管壁附着的银镜 C、可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液 D、除去乙酸乙酯中的乙酸杂质,加入碳酸钠溶液,分液6. 下列描述中正确的是( )。A、原子晶体中只含共价键 B、离子晶体中只含离子键,不含有共价键 C、分子晶体中只存在分子间作用力,不含其它化学键 D、任何晶体中,若含阳离子也一定还有阴离子7. 已知有机物M在一定条件下可转化为N。下列说法正确的是( )
为Si原子的一种激发态
D、中子数为10的氧原子形成的过氧根离子:
5. 下列有关说法错误的是( )A、向Mg(OH)2加入足量稀硫酸,加热浓缩,冷却结晶后得到硫酸镁晶体 B、氨水清除试管壁附着的银镜 C、可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液 D、除去乙酸乙酯中的乙酸杂质,加入碳酸钠溶液,分液6. 下列描述中正确的是( )。A、原子晶体中只含共价键 B、离子晶体中只含离子键,不含有共价键 C、分子晶体中只存在分子间作用力,不含其它化学键 D、任何晶体中,若含阳离子也一定还有阴离子7. 已知有机物M在一定条件下可转化为N。下列说法正确的是( )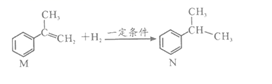 A、该反应类型为取代反应 B、N分子中所有碳原子共平面 C、可用溴水鉴别M和N D、M中苯环上的一氯代物共4种8. 下列解释事实的方程式错误的是( )A、焊接铁轨: 2Fe + Al2O3 2Al + Fe2O3 B、工业固氮: N2 + 3H2 2NH3 C、用纯碱除油污:CO32-+H2O HCO3-+ OH- D、用湿润的淀粉KI试纸检验Cl2:Cl2 + 2I-=2Cl-+I29. CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
A、该反应类型为取代反应 B、N分子中所有碳原子共平面 C、可用溴水鉴别M和N D、M中苯环上的一氯代物共4种8. 下列解释事实的方程式错误的是( )A、焊接铁轨: 2Fe + Al2O3 2Al + Fe2O3 B、工业固氮: N2 + 3H2 2NH3 C、用纯碱除油污:CO32-+H2O HCO3-+ OH- D、用湿润的淀粉KI试纸检验Cl2:Cl2 + 2I-=2Cl-+I29. CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
下列说法中错误的是( )。
A、Ni是该反应的催化剂 B、过程①→②既有碳氧键的断裂,又有碳氧键的形成 C、过程①→②是吸热反应 D、反应的总化学方程式可表示为:CH4 +CO2 2CO+2H210. 硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )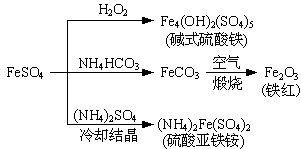 A、碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 B、为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 D、常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大11. 一种新型的锌碘单液流电池,其原理如下图所示。下列说法错误的是 ( )。
A、碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 B、为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 C、可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 D、常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大11. 一种新型的锌碘单液流电池,其原理如下图所示。下列说法错误的是 ( )。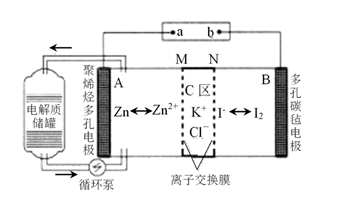 A、放电时B电极反应式为:I2+2e-=2I- B、M为阳离子交换膜,N为阴离子交换膜 C、充电时,A极增重65g时,C区增加离子数为4NA D、放电时电解质储罐中离子总浓度增大12. 常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如下图所示。下列说法错误的是( )。
A、放电时B电极反应式为:I2+2e-=2I- B、M为阳离子交换膜,N为阴离子交换膜 C、充电时,A极增重65g时,C区增加离子数为4NA D、放电时电解质储罐中离子总浓度增大12. 常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如下图所示。下列说法错误的是( )。 A、由图可知,c1>c2>c3 B、M点溶液中存在:c(H+)= [c(A-)-c(HA)]+c(OH-) C、恰好中和时,三种溶液的pH相等 D、由pH=7的溶液计算得:Ka= (V0是消耗的NaOH溶液的体积)
A、由图可知,c1>c2>c3 B、M点溶液中存在:c(H+)= [c(A-)-c(HA)]+c(OH-) C、恰好中和时,三种溶液的pH相等 D、由pH=7的溶液计算得:Ka= (V0是消耗的NaOH溶液的体积)二、综合题
-
13. K、Al、Cu、H、C、O、S、Cl是常见的八种元素。(1)、从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
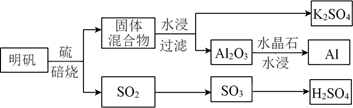
焙烧明矾的化学方程式为。
(2)、K位于元素周期表第周期第族。(3)、S的基态原子核外有个未成对电子;Cl的基态原子核外电子排布式为。(4)、用“>”或“<”填空:第一电离能
离子半径
熔点
酸性
OS
Cl-K+
KClAl2O3
H2SO4HClO4
(5)、SO2的价层电子对个数是 , 该分子为结构为;SO3中硫原子采用杂化方式为。(6)、新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。(7)、Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度g·cm-3(列出计算式子,不必计算出结果)。14. 麻黄素(H)是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。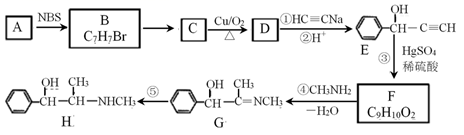
已知:CH3—C≡CH+H2O CH3COCH3
(1)、A的结构简式是;E中官能团的名称为。(2)、反应B→C的反应条件和试剂是 , ⑤的反应类型是。(3)、F的结构简式是。麻黄素(H) 的分子式是。(4)、写出C→D的化学方程式。(5)、化合物F的芳香族同分异构体有多种,结构和性质如下:遇FeCl3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则符合上述要求的同分异构体结构简式可能为。(6)、请仿照题中合成流程图,设计以乙醇为起始主原料合成强吸水性树脂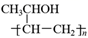 的合成路线(用流程图表示,其它试剂及溶剂任选)。 15. 节能和减排建设友好型社会的必然选择。回答下列问题:(1)、已知在一定温度下,①C(s)+CO2(g) 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
的合成路线(用流程图表示,其它试剂及溶剂任选)。 15. 节能和减排建设友好型社会的必然选择。回答下列问题:(1)、已知在一定温度下,①C(s)+CO2(g) 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ,请写出此反应的热化学方程式 , K1、K2、K3之间的关系是。
(2)、将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g) CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示: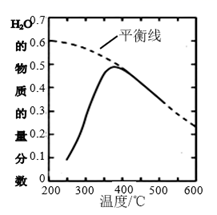
①该反应的平衡常数K随温度降低而(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)、500℃时,CO与水反应生成CO2和H2 , 将其分离得到H2的过程示意图如下:
①阳极反应式是。
②结合电极反应式,简述K2CO3溶液的再生原理。
三、实验题
-
16. 实验室以次氯酸盐和铁盐为原料制备少量K2FeO4的操作步骤如下:(1)、Ⅰ.制备NaClO强碱性饱和溶液:
①将20 mL NaOH溶液加入仪器b中,冷水浴冷却,通入Cl2 , 搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
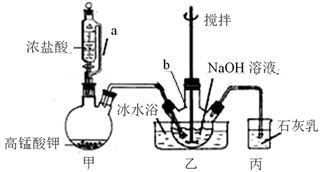
②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20 g NaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
甲装置中a管的作用是。
(2)、写出甲装置中反应的化学方程式。(3)、石灰乳的作用是。(4)、反应过程中用冷水浴冷却的原因是。(5)、Ⅱ.合成K2FeO4:①称取5.05 g Fe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5 min,过滤,得K2FeO4(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13 g。
合成Na2FeO4的离子方程式为。
(6)、过程③加入饱和KOH溶液即可得到K2FeO4粗产品,原因是。(7)、用异丙醇洗涤的目的是。(8)、K2FeO4的产率为(保留至0.1%)。