北京市海淀区2020年高考化学二模试卷
试卷更新日期:2020-07-15 类型:高考模拟
一、单选题
-
1. 下列资源利用过程中,不涉及化学变化的是( )
 A、A B、B C、C D、D2. 利用化学方法可以改善大气质量、进行水处理等。下列说法错误的是( )A、减少化石燃料的燃烧有益于缓解温室效应 B、向天然水中加入明矾可起到杀菌消毒的作用 C、可用熟石灰处理钢铁厂、电镀厂产生的酸性废水 D、在汽车尾气系统中安装催化转化器可减少尾气污染3. 下列物质混合后,能产生蓝色沉淀的是( )A、 溶液与 溶液 B、 溶液与 溶液 C、 溶液与氨水 D、鸡蛋清与浓硝酸4. 2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是( )A、 与 互为同位素 B、 的电子式为
A、A B、B C、C D、D2. 利用化学方法可以改善大气质量、进行水处理等。下列说法错误的是( )A、减少化石燃料的燃烧有益于缓解温室效应 B、向天然水中加入明矾可起到杀菌消毒的作用 C、可用熟石灰处理钢铁厂、电镀厂产生的酸性废水 D、在汽车尾气系统中安装催化转化器可减少尾气污染3. 下列物质混合后,能产生蓝色沉淀的是( )A、 溶液与 溶液 B、 溶液与 溶液 C、 溶液与氨水 D、鸡蛋清与浓硝酸4. 2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是( )A、 与 互为同位素 B、 的电子式为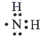 C、 的热稳定性比 的强
D、 中 为 价
5. 下列实验操作能达成实验目的且涉及到氧化还原反应的是( )
C、 的热稳定性比 的强
D、 中 为 价
5. 下列实验操作能达成实验目的且涉及到氧化还原反应的是( )选项
实验目的
实验操作
A
除去 中的
先后通过盛有酸性 溶液、浓硫酸的洗气瓶
B
除去 溶液中的
加入过量 溶液,过滤,向沉淀中加入适量盐酸
C
检验溶液中含有
加入 溶液
D
检验稀硫酸催化淀粉水解的产物为葡萄糖
向水解后的溶液中直接加入新制 ,加热
A、A B、B C、C D、D6. 芹菜中的芹黄素具有抗肿瘤、抗病毒等生物学活性,其熔点为347~348℃,结构简式如下图所示。下列关于芹黄素的说法错误的是( ) A、常温下为固体,需密封保存 B、分子中含有3种含氧官能团 C、与溴水只发生加成反应 D、 芹黄素最多能与 反应7. 将物质的量之比为1:3的氮气和氢气充入恒容密闭容器中,测定不同温度、压强下平衡混合物中氨的物质的量分数,结果如图所示。下列说法错误的是( )
A、常温下为固体,需密封保存 B、分子中含有3种含氧官能团 C、与溴水只发生加成反应 D、 芹黄素最多能与 反应7. 将物质的量之比为1:3的氮气和氢气充入恒容密闭容器中,测定不同温度、压强下平衡混合物中氨的物质的量分数,结果如图所示。下列说法错误的是( ) A、 B、该反应 C、 点, 的转化率为 D、合成氨工业实现了人工固氮8. 实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是( )A、石灰水敞口存放,出现白色固体: B、浓硝酸存放于无色细口瓶中,颜色变黄: C、酸化的硫酸亚铁溶液长时间存放,溶液变黄: D、将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:9. 下列依据实验方案和现象对浓硫酸性质做出的判断合理的是( )
A、 B、该反应 C、 点, 的转化率为 D、合成氨工业实现了人工固氮8. 实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是( )A、石灰水敞口存放,出现白色固体: B、浓硝酸存放于无色细口瓶中,颜色变黄: C、酸化的硫酸亚铁溶液长时间存放,溶液变黄: D、将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:9. 下列依据实验方案和现象对浓硫酸性质做出的判断合理的是( )实验方案
实验I:
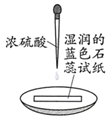
实验II:

实验现象
试纸中心区域变黑,边缘变红
黑色固体溶解,溶液接近无色(溶液中锰元素仅以 存在),产生能使带火星的木条复燃的无色气体
A、由I可知,浓硫酸具有脱水性 B、由I可知,浓硫酸具有弱酸性 C、由II可知,浓硫酸具有强氧化性 D、由II可知,浓硫酸具有吸水性10. 常温下,下列各离子组在指定溶液中能大量存在的是( )A、无色溶液中: B、 的溶液中: C、使石蕊变红的溶液中: D、 的溶液中:11. 丙烷的一溴代反应产物有两种: 和 ,部分反应过程的能量变化如图所示( 表示活化能)。下列叙述错误的是( ) A、 丙烷中有 共价键 B、 与 的反应涉及极性键和非极性键的断裂 C、 D、比较 和 推测生成速率:12. 金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成分为FeO·Cr2O3 , 含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法错误的是( )
A、 丙烷中有 共价键 B、 与 的反应涉及极性键和非极性键的断裂 C、 D、比较 和 推测生成速率:12. 金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成分为FeO·Cr2O3 , 含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法错误的是( ) A、①中需持续吹入空气作氧化剂 B、②中需加入过量稀硫酸 C、③中发生了置换反应 D、溶液A为橙色13. 考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如下图所示:
A、①中需持续吹入空气作氧化剂 B、②中需加入过量稀硫酸 C、③中发生了置换反应 D、溶液A为橙色13. 考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如下图所示: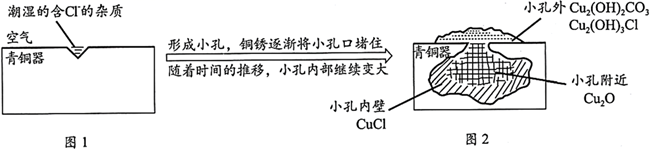
已知:2CuCl+H2O Cu2O+2HCl
下列分析错误的是( )
A、氧气是正极反应物 B、铜锈的成分与氧气浓度、pH有关 C、图2中,Cl-从小孔内向小孔外移动 D、青铜中的锡也会发生电化学腐蚀14. 84消毒液的主要成分是NaCl和NaClO。实验小组同学围绕“84消毒液能否与医用酒精发生反应”这一问题进行了如下实验。序号
实验
现象
①
分别取40 mL84消毒液和医用酒精混合均匀,并测量溶液温度变化
溶液温度由20℃升高至23℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化
②
分别取40 mL医用酒精和蒸馏水混合均匀,水浴至23℃
溶液中无明显现象
③
分别取40 mL84消毒液和蒸馏水混合均匀,水浴至23℃
溶液中无明显现象,略有刺激性气味
④
分别取40 mL84消毒液、40 mL医用酒精和少量白醋,混合均匀
产生大量气泡,有强烈地刺激性气味,溶液逐渐变为淡黄色
下列推理不合理的是( )
A、由①②可知,①中产生的大量气泡与酒精挥发无关 B、由①③可知,①中刺激性气味的产生可能与酒精无关 C、由①②③可推断,84消毒液与医用酒精混合后,溶液中发生了化学反应 D、由①④可推断,酸性条件有利于84消毒液与医用酒精发生反应二、综合题
-
15. “地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+ (RCOO)2Cu
(1)、可利用活性炭对地沟油进行脱色处理,这利用了活性炭的性。(2)、取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。序号
试剂
温度
时间
水解率
a
20 mL3 mol/L H2SO4
95℃
3小时
52.1%
b
20 mL 6 mol/LNaOH
70℃
1.5
97.7%
①实验a中,三油酸甘油酯水解的产物是(填物质名称)。
②对比实验a、b可以得到的结论有(写出2条)。
(3)、将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。
①RCOONa属于(填“离子化合物”或“共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为。
16. 维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。(1)、常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。试剂
pH
初始
通入0.01 mol HCl气体
加入0.01 mol NaOH固体
i.1 L H2O
7
a
12
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液
4.76
4.67
4.85
①a=(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:。
③试剂ii中微粒浓度关系正确的有(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
(2)、缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
Zn+2VOSO4+2H2SO4 ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)(填“增大”“减小”或“不变”),结合化学用语说明理由:。
②充电时,A室中的c(H+)变化缓慢的原因是。
17. H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。(1)、干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
①下列说法正确的是(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是。
(2)、电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的(填“正极”或“负极”)。
②反应器中反应的离子方程式为。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:。
(3)、常用碘量法测定煤气中H2S的含量,其实验过程如下:i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是。
②滴定终点的现象是。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中 的含量为mg/m3。
三、推断题
-
18. 有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如下:
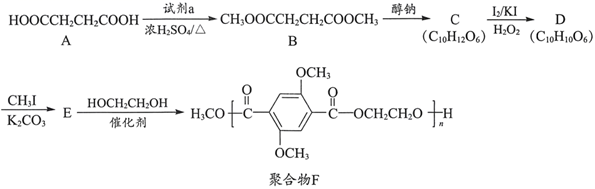
已知:i.
 +R3OH
+R3OHii.
 +R1I
+R1I  +HI
+HIiii.R1COOR2+R3OH R1COOR3+R2OH
(1)、A中官能团的名称为。(2)、试剂a为。(3)、C中含有一个六元环,C的结构简式为。(4)、C→D的反应类型为。(5)、E→F的化学方程式是。(6)、下列说法正确的是(填序号)。a. A能与NaHCO3溶液反应
b. 醇钠可由醇与金属钠反应制得
c. 可用FeCl3溶液鉴别D和E
d. HOCH2CH2OH俗称甘油
(7)、以乙醇为起始原料,利用已知信息、选择必要的无机试剂合成CH3COCH2COOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。四、实验题
-
19. 工业上用 和氨水的混合液浸取废铜矿渣中的单质铜,得到 。某小组同学欲通过实验探究其原理。
(查阅资料)i. 呈深蓝色, ;受热易分解,放出氨气。
ii. 在水溶液中不稳定, 在溶液中只能以 等络合离子的形式稳定存在; 无色,易被氧气氧化为 。
(1)、(实验1)制备 。向盛有 溶液的试管中滴加 氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到 晶体。
资料表明,向 溶液中滴加氨水,可能会生成浅蓝色 沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,(补全实验操作和现象),证明沉淀中含有 。
②补全实验1中生成 沉淀的离子方程式:
+
(2)、甲同学设计实验证明深蓝色溶液中含 :加热深蓝色溶液并检验逸出气体为氨气。你认为此方案(填“可行”或“不可行”),理由是。(3)、(实验2)探究用 和氨水的混合液浸取单质铜得到 的原理。编号
实验装置及部分操作
烧杯中溶液
实验现象
2-1
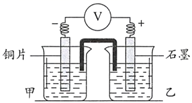
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验, 10 min内记录甲烧杯中现象
甲:
乙:
电压表指针迅速偏转至0.1V;甲中溶液无明显变化
2-2
甲:
乙:
电压表指针迅速偏转至0.3V;甲中溶液无明显变化
2-3
甲: 与 氨水等体积混合
乙:溶液A
电压表指针迅速偏转至0.35V;甲中溶液无明显变化
2-4
甲: 与 氨水等体积混合
乙:
电压表指针迅速编转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
溶液A为。
(4)、对比实验2-1和2-2,可以得到结论是。(5)、实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是。(6)、依据上述实验,分析用 和氨水的混合液浸取单质铜的原理:。
-