北京市海淀区2020年高考化学一模试卷
试卷更新日期:2020-07-15 类型:高考模拟
一、单选题
-
1. 医用外科口罩的结构示意图如下图所示,其中过滤层所用的材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用。

下列关于医用外科口罩的说法错误的是( )
A、防水层具有阻隔飞沫进入口鼻内的作用 B、熔喷聚丙烯属于合成高分子材料 C、熔喷聚丙烯材料难溶于水 D、用完后应投入有 标志的垃圾箱
2. 人类的生命健康与化学息息相关。下列说法正确的是( )A、油脂是人体不可缺少的营养物质 B、淀粉没有甜味,糖尿病患者多食无碍 C、重金属盐溶液能使蛋白质盐析,会使人中毒 D、纤维素在人体内能水解为葡萄糖,为人体提供营养3. 下列关于各物质的所属类别及性质的描述错误的是( )
标志的垃圾箱
2. 人类的生命健康与化学息息相关。下列说法正确的是( )A、油脂是人体不可缺少的营养物质 B、淀粉没有甜味,糖尿病患者多食无碍 C、重金属盐溶液能使蛋白质盐析,会使人中毒 D、纤维素在人体内能水解为葡萄糖,为人体提供营养3. 下列关于各物质的所属类别及性质的描述错误的是( )选项
A
B
C
D
物质
乙烯
氯化钠
氢氧化铁胶体
生铁
类别
烃
离子化合物
混合物
合金
性质
不可燃
熔融态能导电
能产生丁达尔现象
易发生电化学腐蚀
A、A B、B C、C D、D4. 砷化镓( GaAs)是一种优良的半导体材料。镓与铝同主族,镓与砷同周期,砷与氮同主族。下列说法错误的是( )A、Ga位于元素周期表第IIIA族 B、Ga的原子半径比As的大 C、AsH3的热稳定性比PH3的弱 D、H3AsO4的酸性比HNO3的强5. 下列实验装置或操作与实验目的不相符的是( )A、 证明Cl2氧化性强于Br2
B、
证明Cl2氧化性强于Br2
B、 分离乙醇和水
C、
分离乙醇和水
C、 除去水中泥沙
D、
除去水中泥沙
D、 配制100mL0.100mol/LNaCl溶液
6. 下列说法正确的是( )A、1 mol O2的体积为22.4 L B、5.6 g Fe与足量Cl2反应,转移电子的物质的量为0.3 mol C、0.1 mol/L AlCl3溶液中Cl-的物质的量为0.3 mol D、28g丁烯所含碳原子数是28 g乙烯所含碳原子数的2倍7. 下列化学用语对事实的表述正确的是( )A、.由H和Cl形成HCl的过程:
配制100mL0.100mol/LNaCl溶液
6. 下列说法正确的是( )A、1 mol O2的体积为22.4 L B、5.6 g Fe与足量Cl2反应,转移电子的物质的量为0.3 mol C、0.1 mol/L AlCl3溶液中Cl-的物质的量为0.3 mol D、28g丁烯所含碳原子数是28 g乙烯所含碳原子数的2倍7. 下列化学用语对事实的表述正确的是( )A、.由H和Cl形成HCl的过程: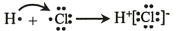 B、常温时,饱和NaClO溶液的pH约为11:ClO-+H2O=HClO+OH-
C、苯酚和甲醛在一定条件下反应能生成酚醛树脂:
B、常温时,饱和NaClO溶液的pH约为11:ClO-+H2O=HClO+OH-
C、苯酚和甲醛在一定条件下反应能生成酚醛树脂:  D、电解饱和食盐水的反应:2Cl-+2H+ Cl2↑+H2↑
8. 下图为实验室制取乙炔并验证其性质的实验装置(夹持装置己略去)。下列说法正确的是( )
D、电解饱和食盐水的反应:2Cl-+2H+ Cl2↑+H2↑
8. 下图为实验室制取乙炔并验证其性质的实验装置(夹持装置己略去)。下列说法正确的是( ) A、用饱和食盐水替代水的目的是加快反应速率 B、CuSO4溶液的作用是除去杂质 C、酸性KMnO4溶液褪色说明乙炔具有漂白性 D、可用向上排空气法收集乙炔9. 利用天然气水蒸气重整制备H2的反应为CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H>0,每次只改变一种条件(X),其它条件不变,CH4的平衡转化率 随X的变化趋势如下图所示。下列说法正确的是( )
A、用饱和食盐水替代水的目的是加快反应速率 B、CuSO4溶液的作用是除去杂质 C、酸性KMnO4溶液褪色说明乙炔具有漂白性 D、可用向上排空气法收集乙炔9. 利用天然气水蒸气重整制备H2的反应为CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H>0,每次只改变一种条件(X),其它条件不变,CH4的平衡转化率 随X的变化趋势如下图所示。下列说法正确的是( ) A、X为温度时, 的变化趋势为曲线N B、X为压强时, 的变化趋势为曲线M C、X为投料比 时, 的变化趋势为曲线N D、某条件下,若CH4(g)、H2O(g)初始浓度均为0.2 mol/L, = 25%,则K=310. 某化工厂生产硝酸的流程如图l所示;其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的关系如图2所示。下列说法错误的是( )
A、X为温度时, 的变化趋势为曲线N B、X为压强时, 的变化趋势为曲线M C、X为投料比 时, 的变化趋势为曲线N D、某条件下,若CH4(g)、H2O(g)初始浓度均为0.2 mol/L, = 25%,则K=310. 某化工厂生产硝酸的流程如图l所示;其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的关系如图2所示。下列说法错误的是( )
 A、该流程中,装置①③④中发生了氧化还原反应 B、装置②中利用氨易液化的性质实现反应物和生成物的分离 C、装置③中最佳反应条件是铂网成分为纯铂、温度为900℃ D、装置④中通入过量空气可以提高硝酸的产率11. AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度随时间变化关系如下图所示。燃烧不同阶段发生的主要变化如下:
A、该流程中,装置①③④中发生了氧化还原反应 B、装置②中利用氨易液化的性质实现反应物和生成物的分离 C、装置③中最佳反应条件是铂网成分为纯铂、温度为900℃ D、装置④中通入过量空气可以提高硝酸的产率11. AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度随时间变化关系如下图所示。燃烧不同阶段发生的主要变化如下:2AlH3(g)=2Al(s)+3H2(g) △H1 H2(g)+ O2(g)=H2O(g) △H2 Al(s)= Al(g) △H3 Al(g) + O2(g)= Al2O3(s) △H4

下列分析正确的是( )
A、AlH3燃烧需要激光加热引发,所以AlH3燃烧是吸热反应 B、其他条件相同时,等物质的量的Al(s)燃烧放热大于Al(g)燃烧放热 C、在反应过程中,a点时物质所具有的总能量最大 D、2AlH3(s)+3O2(g)=Al2O3(s)+3H2O(g) △H=△H1+3△H2+2△H3+2△H412. 某同学在室温下进行下图所示实验。(已知:H2C2O4为二元弱酸)
试管a、b、c中溶液褪色分别耗时690s、677s、600s。下列说法正确的是( )
A、反应的离子方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O B、试管c反应至300 s时,溶液中剩余的c(KMnO4)=0.0025 mol/L C、对比试管a、b,得到的结论是H2C2O4水溶液浓度增大,反应速率加快 D、对比试管c、d,可验证H+浓度对反应速率的影响13. 常温下,将NH3通入50 mL NH4Cl溶液中至pH=10,再向其中滴加1 mol/L盐酸。溶液的pH随加入盐酸体积的变化如下图所示。
下列说法错误的是( )
A、a点溶液中,c(OH-)=1×10-4 mol/L B、b点溶液中,c(NH4+)>c(Cl-) C、c点时,加入的n(HCl)小于通入的n(NH3) D、a→b,水的电离程度减小14. 国家标准规定,室内甲醛含量不能超过0.08 mg/m3。银一菲洛嗪法可用于测定空气中甲醛含量,其原理为:①Ag2O将甲醛氧化为CO2;②产生的Ag与酸化的Fe2(SO4)3溶液反应生成FeSO4;③FeSO4与菲洛嗪(一种有机钠盐)形成有色配合物,一定波长下其吸光度与Fe2+的质量浓度成正比。下列关于a~c的判断正确的是( )a.反应①的化学方程式为HCHO+2Ag2O=CO2↑+ 4Ag↓+H2O
b.理论上吸收的HCHO与消耗的Fe3+的物质的量比为1:4
c.取1m3空气,经上述实验后共得到Fe2+ 1.12 mg,室内甲醛含量达标
A、a正确,b、c错误 B、a、b正确,c错误 C、b、c正确,a错误 D、全部正确二、综合题
-
15. 硫是人类认识最早的元素之一,含硫物质在现代生产和生活中发挥着重要作用。(1)、我国化学家姜雪峰因其在绿色有机硫化学领域的杰出贡献被遴选为“全球青年化学家元素周期表硫元素代表”。
①硫元素在元素周期表中的位置是 。
②乙硫醇(CH3CH2SH)是一种含硫有机物,其分子中S-H的极性小于CH3CH2OH分子中O-H的极性,请从原子结构角度解释其原因:。
(2)、自然界的硫循环过程如下图所示。
①上图所涉及的含硫物质中,能使品红溶液褪色的是。
②降解石油(主要成分为CxHy)的过程中,在细菌催化作用下,石油与硫酸盐反应转化为碳酸氢盐,硫酸盐做(填“氧化剂”或“还原剂”)。
③煤炭中的硫化物主要为FeS2(S为-1价)。在潮湿的环境中,FeS2可在氧化亚铁硫杆菌(T.f)的作用下被空气氧化为Fe2(SO4)3 , 该反应的化学方程式为。
16. 镍镉电池是应用广泛的二次电池,其总反应为:Cd+2NiOOH+2H2O 2Ni(OH)2+Cd(OH)2
制造密封式镍镉电池的部分工艺如下:
(1)、I.Ni(OH)2的制备以硫酸镍(NiSO4)为原料制备Ni(OH)2的主要过程如下图所示。制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能。
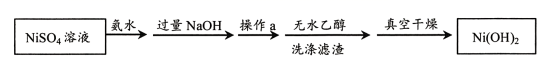
已知:Ni2++6NH3•H2O⇌[Ni(NH3)6]2++6H2O
操作a是 。
(2)、制备过程中,需先加氨水,再加过量NaOH,请分析:①先加氨水的目的是 。
②用化学平衡移动原理分析加入NaOH需过量的原因是。
(3)、用无水乙醇代替水洗涤滤渣的优点是答出1条即可)。(4)、II.镍镉电池的组装主要步骤:①将Ni(OH)2和Cd(OH)2固定,中间以隔膜隔开(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
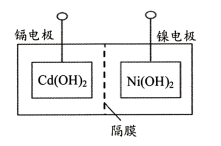
下列对镍镉电池组装和使用的分析正确的是(填字母序号)。
a.密封镍镉电池可以避免KOH变质
b.镍电极为电池的负极,镉电极为电池的正极
c.电池组装后,应先充电,再使用
(5)、III.过度充电的保护电池充电时,若Cd(OH)2和Ni(OH)2耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的Cd(OH)2可对电池进行过度充电保护,该方法称为镉氧循环法。
Cd(OH)2耗尽后继续充电,镉电极上生成的物质为。
(6)、已知:①隔膜可以透过阴离子和分子:②O2可以与Cd发生反应生成Cd(OH)2。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理:。17. 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq)⇌CH3CO3H(aq)+H2O(l) △H=-13.7KJ/mol(1)、市售过氧乙酸的浓度一般不超过21%,原因是 。(2)、利用上述反应制备760 9 CH3CO3H,放出的热量为kJ。(3)、取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。实验1:在25 ℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应,测定24小时所得溶液中过氧乙酸的质量分数,数据如图2所示。

①实验1中,若反应混合液的总质量为mg,依据图1数据计算,在0—6h间,v(CH3CO3H)= g/h(用含m的代数式表示)。
②综合图1、图2分析,与20 ℃相比,25 ℃时过氧乙酸产率降低的可能原因是。(写出2条)。
(4)、SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40 nm和70 nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
18. 聚合物L具有特殊的光学性质,可用于光电材料,其合成路线如下:
已知:
i.有机物可用键线式表示,如
 可表示为
可表示为 
 (1)、A—B的化学方程式为。(2)、D的结构简式为。(3)、E中含有的含氧官能团为 。(4)、G—H的反应类型为。(5)、I—K的化学方程式为。(6)、下列说法正确的是填字母序号)。
(1)、A—B的化学方程式为。(2)、D的结构简式为。(3)、E中含有的含氧官能团为 。(4)、G—H的反应类型为。(5)、I—K的化学方程式为。(6)、下列说法正确的是填字母序号)。a.A分子中所有碳原子均在同一平面 b.C的结构简式为
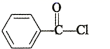
c.F+F—G的副产物中有2种互为顺反异构体 d.1 mol H最多能与2 molNaOH反应
(7)、乳酸乙酯 是合成
是合成  的中间体。下图是某同学设计的合成乳酸乙酯的流程。
的中间体。下图是某同学设计的合成乳酸乙酯的流程。 
请写出M-P的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
三、实验题
-
19. 某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+ , 并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
 (1)、I.初步探究
(1)、I.初步探究实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
编号
饱 和
(NH4)2Fe(SO4)2溶液
饱和碘水
石蜡油
操作
KSCN溶液
现象
2-1
1滴
5mL
1mL
不加热
1滴
无明显现象
2-2
1滴
5mL
1mL
加热一段时间后冷却
1滴
无明显现象
研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为。
(2)、实验2中,加入石蜡油的目的是。(3)、小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是。(4)、II.查阅资料,继续探究(资料)AgSCN为不溶于水的白色固体。

试管a的实验现象说明滤液l中含有。
(5)、试管b中,加入KSCN溶液后所产生实验现象的原因是 。(6)、甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。编号
实验操作
实验现象
4
在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液
溶液不变红
①试剂a是 。
②依据实验4,甲同学做出判断:
(7)、根据实验1~4所得结论是。