北京市东城区2020年高考化学一模试卷
试卷更新日期:2020-07-15 类型:高考模拟
一、单选题
-
1. 下列行为不合理或不符合安全要求的是( )A、用较热的纯碱溶液清洗碗筷上的油污 B、向室内空气中喷洒高浓度酒精进行消毒 C、用稀释的84消毒液漂白白色棉织物上的污渍 D、油锅炒菜着火时,关掉炉灶燃气阀门,盖上锅盖2. 对下列过程的化学用语表述正确的是( )A、把钠加入水中,有气体生成:2Na + H2O = Na2O+H2↑ B、用稀硫酸做导电实验,灯泡发光: H2O H++OH- C、向Al2(SO4)3溶液中滴加氨水,生成白色沉淀:Al3+ + 3OH- =Al(OH)3↓ D、用电子式表示NaCl的形成过程:
 3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是( )
3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是( )



A.蘸有浓盐酸和浓氨水的玻璃棒靠近
B.铝丝伸入硫酸铜溶液中
C.测定空气中氧气含量
D.向蔗糖中加入浓硫酸
A、A B、B C、C D、D4. 阅读体检报告呈现的的部分内容,判断下列说法错误的是( )项目名称
检查结果
单位
参考范围
钾
4.1
mmol/L
3.5~5.5
钙
2.15
mmol/L
2.13~2.70
胱抑素C
0.78
mg/L
0.59~1.03
尿素
4.18
mmol/L
2.78~7.14
甘油三酯
1.50
mmol/L
0.45~1.70
A、体检指标均以物质的量浓度表示 B、表中所示的检查项目均正常 C、尿素是蛋白质的代谢产物 D、甘油三酯的结构可表示为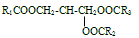 (R1、R2、R3为烃基)
5. 硒(34Se)元素是人体必需的微量元素之一,与溴同周期。下列说法错误的是( )A、原子半径由大到小顺序:Se>Br>Cl B、氢化物的稳定性:硒化氢<水<氟化氢 C、SeO2和NaOH溶液反应生成Na2SeO4和水 D、SeO2既可发生氧化反应,又可发生还原反应6. 下列实验操作中选用的部分仪器,错误的是( )
(R1、R2、R3为烃基)
5. 硒(34Se)元素是人体必需的微量元素之一,与溴同周期。下列说法错误的是( )A、原子半径由大到小顺序:Se>Br>Cl B、氢化物的稳定性:硒化氢<水<氟化氢 C、SeO2和NaOH溶液反应生成Na2SeO4和水 D、SeO2既可发生氧化反应,又可发生还原反应6. 下列实验操作中选用的部分仪器,错误的是( ) A、盛放NaOH溶液,选用④ B、从食盐水中获得食盐,选用①、⑥、⑦ C、分离I2的四氯化碳溶液和水,选用②、③ D、配制100 mL 0.1 mol·L-1 NaCl溶液,选用③、⑤、⑥和⑧7. 已知:①C2H6(g) C2H4(g)+H2(g) DH1 >0。
A、盛放NaOH溶液,选用④ B、从食盐水中获得食盐,选用①、⑥、⑦ C、分离I2的四氯化碳溶液和水,选用②、③ D、配制100 mL 0.1 mol·L-1 NaCl溶液,选用③、⑤、⑥和⑧7. 已知:①C2H6(g) C2H4(g)+H2(g) DH1 >0。②C2H6(g)+ =2CO2(g)+3H2O(l) DH 2 =-1559.8 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) DH 3=-1411.0 kJ·mol-1
下列叙述正确的是( )
A、升温或加压均能提高①中乙烷的转化率 B、①中断键吸收的能量少于成键放出的能量 C、用DH 2和DH 3可计算出①中的DH D、推测1 mol C2H2(g)完全燃烧放出的热量小于1411.0 kJ8. 已知苯可以进行如下转化: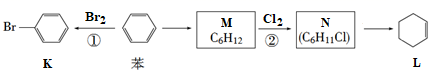
下列叙述正确的是( )
A、用蒸馏水可鉴别苯和化合物K B、化合物M与L互为同系物 C、①、②反应发生的条件均为光照 D、化合物L能发生加成反应,不能发生取代反应9. 常温常压下,下列实验方案能达到实验目的的是( )实验目的
实验方案
A
证明苯酚有弱酸性
向苯酚浊液中加入NaOH溶液
B
证明葡萄糖中含有羟基
向葡萄糖溶液中加入高锰酸钾酸性溶液
C
比较镁和铝的金属性强弱
用pH试纸分别测量MgCl2和AlCl3溶液的pH
D
测定过氧化钠样品(含少量氧化钠)的纯度
向a g样品中加入足量水,测量产生气体的体积
A、A B、B C、C D、D10. 科研人员提出CeO2催化合成DMC需经历三步反应,示意图如下:
下列说法正确的是( )
A、①、②、③中均有O—H的断裂 B、生成DMC总反应的原子利用率为100% C、该催化剂可有效提高反应物的平衡转化率 D、DMC与过量NaOH溶液反应生成 和甲醇11. 25oC时,浓度均为0.1 mol·L–1的几种溶液的pH如下:溶液
①CH3COONa溶液
②NaHCO3溶液
③CH3COONH4溶液
pH
8.88
8.33
7.00
下列说法错误的是( )
A、①中, c(Na+) = c(CH3COO–) + c( CH3COOH) B、由①②可知,CH3COO–的水解程度大于 的水解程度 C、③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1 D、推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.3312. 如图所示装置,两个相同的玻璃管中盛满NaCl稀溶液(滴有酚酞),a、b为多孔石墨电极。闭合S1一段时间后,a附近溶液逐渐变红;断开S1 , 闭合S2 , 电流表指针发生偏转。
下列分析错误的是( )
A、闭合S1时,a附近的红色逐渐向下扩散 B、闭合S1时, a附近液面比b附近的低 C、断开S1、闭合S2时,b附近黄绿色变浅 D、断开S1、闭合S2时,a上发生反应:H2 ˗ 2e- = 2H+13. 取某品牌加碘食盐(其包装袋上的部分说明如下)配成溶液,加入少量淀粉和稀盐酸后分成2份于试管中,分别进行下列实验。配料
含碘量(以I 计)
食用方法
精制盐、碘酸钾、亚铁氰化钾(抗结剂)
(35+15)mg/kg
待食品熟后加入碘盐
①加入FeCl2溶液,振荡,溶液由无色变蓝色。
②加入KI溶液,振荡,溶液由无色变蓝色。
下列分析合理的是( )
A、碘酸钾的化学式为KIO4 , 受热易分解 B、①或②都能说明食盐中含碘酸钾,其还原产物为I2 C、一袋(200 g)食盐中含 I 为5×10-5 mol 时,符合该包装说明 D、食盐中添加碘酸钾与亚铁氰化钾的目的均与反应速率有关14. 298 K时, γ-羟基丁酸水溶液发生如下反应,生成 丁内酯: HOCH2CH2CH2COOH +H2O
+H2O 不同时刻测得 丁内酯的浓度如下表。
20
50
80
100
120
160
220
∞
0.024
0.050
0.071
0.081
0.090
0.104
0.116
0.132
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是( )
A、增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率 B、298 K时,该反应的平衡常数为2.75 C、反应至120 min时,γ-羟基丁酸的转化率<50% D、80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol ∙ L-1∙min-1二、综合题
-
15. 文物是人类宝贵的历史文化遗产,我国文物资源丰富,但保存完好的铁器比青铜器少得多,研究铁质文物的保护意义重大。
 (1)、铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是。(2)、已知:
(1)、铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是。(2)、已知:ⅰ.铁质文物在潮湿的土壤中主要发生吸氧腐蚀,表面生成疏松的FeOOH;
ⅱ.铁质文物在干燥的土壤中表面会生成致密的Fe2O3 , 过程如下。

①写出ⅰ中,O2参与反应的电极反应式和化学方程式:、。
②若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为。
③结合已知信息分析,铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重的主要原因是。
(3)、(资料1)Cl–体积小穿透能力强,可将致密氧化膜转化成易溶解的氯化物而促进铁质文物继续锈蚀。(资料2)Cl–、Br–、I–促进铁器皿继续锈蚀的能力逐渐减弱。
①写出铁质文物表面的致密氧化膜被氯化钠破坏的化学方程式。
②结合元素周期律解释“资料2”的原因是。
(4)、从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使Cl-渗出后,取最后一次浸泡液加入试剂 (填化学式)检验脱氯处理是否达标。(5)、经脱氯、干燥处理后的铁质文物再“覆盖”一层透明的高分子膜可以有效防止其在空气中锈蚀。下图为其中一种高分子膜的片段:
该高分子的单体是。
16. 研究来源于真菌的天然产物L的合成对抗肿瘤药物研发有着重要意义,其合成路线主要分为两个阶段:
I.合成中间体F
已知:ⅰ.TBSCl为

ⅱ.
 (1)、A中含氧官能团名称。(2)、B的结构简式是。(3)、试剂a是。(4)、TBSCl的作用是。(5)、II. 合成有机物L
(1)、A中含氧官能团名称。(2)、B的结构简式是。(3)、试剂a是。(4)、TBSCl的作用是。(5)、II. 合成有机物L
已知:

H中含有两个酯基,H的结构简式是。
(6)、I→J的反应方程式是。(7)、K→L的转化中,两步反应的反应类型依次是、。17. 液相催化还原法去除水体中 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。(1)、Ⅰ.制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
该过程中,乙醇发生(填“氧化”或“还原”)反应。
(2)、请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图。(3)、Ⅱ.Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
该液相催化还原法中所用的还原剂是。
(4)、i的离子方程式是。(5)、研究表明,OH–在Pd表面与 竞争吸附,会降低Pd吸附 的能力,但对Pd吸附H的能力影响不大。①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是 , 导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中 的变化趋势是 , 说明Pd表面吸附的 和H的个数比变大,对反应(用离子方程式表示)更有利。
(6)、使用Pd-Cu/TiO2 , 通过调节溶液pH,可将 尽可能多地转化为N2 , 具体方法是。三、实验题
-
18. 绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。(1)、Ⅰ.醋酸铜晶体的制备

①中,用离子方程式表示产物里OH-的来源是。
(2)、②中,化学方程式是。(3)、③中采用的实验方法依据醋酸铜的性质是。(4)、Ⅱ.测定产品中铜的含量ⅰ.取a g醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产生CuI沉淀,溶液呈棕黄色;
ⅱ.用b mol·L-1 Na2S2O3标准溶液滴定ⅰ中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;
ⅲ.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
ⅳ.继续用Na2S2O3 标准溶液滴定ⅲ中浊液至终点,消耗标准溶液v mL。
已知:① ,Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②CuI易吸附I2 , CuSCN难溶于水且不吸附I2。被吸附的I2不与淀粉显色。
ⅰ中发生反应的离子方程式是。
(5)、结合离子方程式说明,ⅲ中加入KSCN的目的是。(6)、醋酸铜产品中铜元素的质量分数是。19. “硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。(1)、(实验一)
A为Ag2S2O3。写出生成A的离子方程式。
(2)、对实验现象的分析得出,试管a中充分反应后一定生成了(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是。(3)、若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:。结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(4)、(实验二)已知:Ag2S2O3 +3S2O32- 2 [ Ag(S2O3)2]3–(无色)实验操作
实验现象
i.

白色沉淀生成,振荡后迅速溶解,得到无色清液;
滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象;
超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色;
滴加完毕,静置,得到黑色沉淀,上层清液pH = 5
ii.

白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。
用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:。
(5)、实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是。(6)、简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:。