2020年天津卷化学高考试题
试卷更新日期:2020-07-14 类型:高考真卷
一、选择题
-
1. 在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是( )A、NaOH B、NaCl C、NaClO D、Na2CO32. 晋朝葛洪的《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,受此启发为人类做出巨大贡献的科学家是( )A、屠呦呦 B、钟南山 C、侯德榜 D、张青莲3. 下列说法错误的是( )A、淀粉和纤维素均可水解产生葡萄糖 B、油脂的水解反应可用于生产甘油 C、氨基酸是组成蛋白质的基本结构单元 D、淀粉、纤维素和油脂均是天然高分子4. 下列离子方程式书写正确的是( )A、CaCO3与稀硝酸反应: B、FeSO4溶液与溴水反应: C、NaOH溶液与过量H2C2O4溶液反应: D、C6H5ONa溶液中通入少量CO2:5. 下列实验仪器或装置的选择正确的是( )



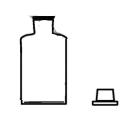
配制50.00mL0.1000mol.L-1
Na2CO3溶液
除去Cl2中的HCl
蒸馏用冷凝管
盛装Na2SiO3溶液的试剂瓶
A
B
C
D
A、A B、B C、C D、D6. 检验下列物所选用的试剂正确的是( )待检验物质
所用试剂
A
海水中的碘元素
淀粉溶液
B
SO2气体
澄清石灰水
C
溶液中的Cu2+
氨水
D
溶液中的
NaOH溶液,湿润的蓝色石蕊试纸
A、A B、B C、C D、D7. 常温下,下列有关电解质溶液的说法错误的是( )A、相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则 B、相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中 C、FeS溶于稀硫酸,而CuS不溶于稀硫酸,则 D、在 溶液中,8. 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )元素
X
Y
Z
W
最高价氧化物的水化物
H3ZO4
溶液对应的pH(25℃)
1.00
13.00
1.57
0.70
A、元素电负性:Z<W B、简单离子半径:W<Y C、元素第一电离能:Z<W D、简单氢化物的沸点:X<Z9. 关于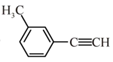 的说法正确的是( ) A、分子中有3种杂化轨道类型的碳原子 B、分子中共平面的原子数目最多为14 C、分子中的苯环由单双键交替组成 D、与Cl2发生取代反应生成两种产物10. 理论研究表明,在101kPa和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是( )
的说法正确的是( ) A、分子中有3种杂化轨道类型的碳原子 B、分子中共平面的原子数目最多为14 C、分子中的苯环由单双键交替组成 D、与Cl2发生取代反应生成两种产物10. 理论研究表明,在101kPa和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是( ) A、HCN比HNC稳定 B、该异构化反应的 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热11. 熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为 (x=5~3,难溶于熔融硫),下列说法错误的是( )
A、HCN比HNC稳定 B、该异构化反应的 C、正反应的活化能大于逆反应的活化能 D、使用催化剂,可以改变反应的反应热11. 熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为 (x=5~3,难溶于熔融硫),下列说法错误的是( ) A、Na2S4的电子式为
A、Na2S4的电子式为 B、放电时正极反应为
C、Na和Na2Sx分别为电池的负极和正极
D、该电池是以 为隔膜的二次电池
12. 已知 呈粉红色, 呈蓝色, 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
B、放电时正极反应为
C、Na和Na2Sx分别为电池的负极和正极
D、该电池是以 为隔膜的二次电池
12. 已知 呈粉红色, 呈蓝色, 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: ,用该溶液做实验,溶液的颜色变化如下:
以下结论和解释正确的是( )
A、等物质的量的 和 中σ键数之比为3:2 B、由实验①可推知△H<0 C、实验②是由于c(H2O)增大,导致平衡逆向移动 D、由实验③可知配离子的稳定性:二、非选择题
-
13. Fe、Co、Ni是三种重要的金属元素。回答下列问题:(1)、Fe、Co、Ni在周期表中的位置为 , 基态Fe原子的电子排布式为。(2)、CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA , 则CoO晶体的密度为g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。
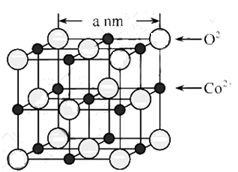 (3)、Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为 , Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:。(4)、95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为。
(3)、Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为 , Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:。(4)、95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为。 14. 天然产物H具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
14. 天然产物H具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
已知:
 ( 等)
( 等)回答下列问题:
(1)、A的链状同分异构体可发生银镜反应,写出这些同分异构体所有可能的结构:。(2)、在核磁共振氢谱中,化合物B有组吸收峰。(3)、化合物X的结构简式为。(4)、D→E的反应类型为。(5)、F的分子式为 , G所含官能团的名称为。(6)、化合物H含有手性碳原子的数目为 , 下列物质不能与H发生反应的是(填序号)。a.CHCl3 b.NaOH溶液 c.酸性KMnO4溶液 d.金属Na
(7)、以 和
和 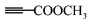 为原料,合成
为原料,合成 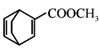 ,写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)。 15. 为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:(1)、Ⅰ.甲方案
,写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)。 15. 为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。回答下列问题:(1)、Ⅰ.甲方案实验原理:
实验步骤:

判断 沉淀完全的操作为。
(2)、步骤②判断沉淀是否洗净所选用的试剂为。(3)、步骤③灼烧时盛装样品的仪器名称为。(4)、固体质量为wg,则c(CuSO4)=mol‧L-1。(5)、若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。(6)、Ⅱ.乙方案实验原理: ,

实验步骤:
①按上图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E…中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
步骤②为。
(7)、步骤⑥需保证体系恢复到室温的原因是(填序号)。a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
(8)、Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下 ,则c(CuSO4)mol‧L-1(列出计算表达式)。(9)、若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。(10)、是否能用同样的装置和方法测定MgSO4溶液的浓度:(填“是”或“否”)。16. 利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题:(1)、Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物下图为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为。
 (2)、若将该催化剂置于Na2SO3溶液中,产物之一为 ,另一产物为。若将该催化剂置于AgNO3溶液中,产物之一为O2 , 写出生成另一产物的离子反应式。(3)、Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):
(2)、若将该催化剂置于Na2SO3溶液中,产物之一为 ,另一产物为。若将该催化剂置于AgNO3溶液中,产物之一为O2 , 写出生成另一产物的离子反应式。(3)、Ⅱ.用H2还原CO2可以在一定条下合成CH3OH(不考虑副反应):某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol‧L-1和3 a mol‧L-1 , 反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为。
(4)、恒压下,CO2和H2的起始物质的量比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。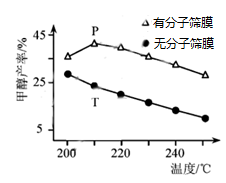
①甲醇平衡产率随温度升高而降低的原因为。
②P点甲醇产率高于T点的原因为。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为℃。
(5)、Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放的空间构型为。已知25℃碳酸电离常数为Ka1、Ka2 , 当溶液pH=12时, =1::。